
【题目】小明从表中提供的信息中,得出以下几个结论,其中正确的是

A. 热值大的燃料燃烧时放出的热量多
B. 1千克汽油燃烧时放出的热量是4.6×107焦耳
C. 木炭燃烧不充分时其热值会变小
D. 2m3的沼气完全燃烧时放出的热量是3.8×107焦耳
科目:高中化学 来源: 题型:
【题目】100℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) ![]() 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
①N2O4的消耗速率与NO2的生成速率之比为1∶2;②NO2的生成速率与NO2消耗速率相等;③烧瓶内气体的压强不再变化;④烧瓶内气体的质量不再变化;⑤NO2的物质的量浓度不再改变;⑥烧瓶内气体的颜色不再加深;⑦烧瓶内气体的平均相对分子质量不再变化;⑧烧瓶内气体的密度不再变化。
A. ②③⑥⑦ B. ①④⑧
C. 只有①④ D. 只有⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,已达平衡的可逆反应:2A(g)+B(g)![]() 2C(g),下列说法中正确的是 ( )
2C(g),下列说法中正确的是 ( )
A. 平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=![]()
B. 改变条件后,该反应的平衡常数K一定不变
C. 如果改变压强并加入催化剂,平衡常数会随之变化
D. 若平衡时增加A和B的浓度,则平衡常数会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某核素![]() 的氯化物XCl2 0.95g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
的氯化物XCl2 0.95g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
(1)X的质量数为_________。
(2)若X的核内中子数为12,求47.5gXCl2中所含质子的物质的量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迄今为止,煤、石油和天然气等化石能源仍然是人类使用的主要能源。下列有关煤、石油、天然气等资源的说法正确的是
A. 石油裂解可以得到汽油,这种汽油是一种纯净物
B. 煤的气化就是将煤在高温条件由固态转化为气态的变化过程
C. 天然气是一种清洁的化石燃料
D. 煤就是碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个实验室制取氯气并以氯气为原料进行一系列反应的装置,回答下列问题。(已知:①MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑,②Cl2+SO2+2H2O=2HCl+H2SO4,③ Ba(OH)2+CO2=BaCO3↓+H2O)
MnCl2+2H2O+Cl2↑,②Cl2+SO2+2H2O=2HCl+H2SO4,③ Ba(OH)2+CO2=BaCO3↓+H2O)

(1)写出a仪器的名称___;
(2)装置D产生白色沉淀现象的原因___________;
(3)E装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,其产物为CO2和HCl。试写出E中反应的化学方程式_______;
(4)F处的烧杯溶液中最终___(填“有”或“没有”)白色沉淀;
(5)F装置无法确认E处反应中有CO2产生,为了证明CO2的存在,要对F装置进行改造,下列装置符合要求的是___。
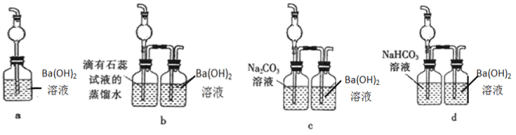
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取100.0 mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到16.84g沉淀,用过量稀硝酸处理后沉淀质量减少至6.99g,同时溶液中有气泡产生。试求:
(1)原混合液中Na2SO4的物质的量浓度为_____;
(2)产生的气体在标准状况下的体积为多少__________?(要求写出计算过程,只写结果不给分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大量排放氮的氧化物会产生酸雨、光化学烟雾等环境问题,工业上常用天然气还原法处理氮的氧化物。
(1) CH4催化还原NO 、NO2的热化学方程式如下:
序号 | 热化学方程式 |
① | 4NO2(g)+ CH4 (g) |
② | 4NO(g)+ CH4 (g) |
则4NO(g)![]() N2(g) +2NO2(g)的ΔH=___________________。
N2(g) +2NO2(g)的ΔH=___________________。
(2)T1℃时,在一密闭容器中发生反应4NO(g)![]() N2(g) +2NO2(g),其正反应速率表达式为:v正= k正·cn(NO),测得速率和浓度的关系如下表。
N2(g) +2NO2(g),其正反应速率表达式为:v正= k正·cn(NO),测得速率和浓度的关系如下表。
序号 | c(NO)/mol·L-1 | v正/mol·L-1·s-1 |
① | 0.10 | 4.00×10-9 |
② | 0.20 | 6.40×10-8 |
③ | 0.30 | 3.24×10-7 |
则n=_____________,k正=________________mol-3·L3·S-1。达到平衡后,若减小压强,则混合气体的平均相对分子质量将_______________(填“增大”、“减小”或“不变”)。
(3)利用测压法在刚性密闭容器中研究T2℃时4NO(g)![]() N2(g)+2NO2(g)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
N2(g)+2NO2(g)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
反应时间/min | 0 | 10 | 20 | 30 | 40 |
压强/MPa | 15.00 | 14.02 | 13.20 | 12.50 | 12.50 |
①20 min时,NO的转化率α =____________﹪。
②T2℃时4NO(g)![]() N2(g)+2NO2(g)反 应的平衡常数Kp=_______MPa-1 (Kp为以分压表示的平衡常数)。若升高温度,该反应的平衡常数Kp将______ (填“增大”、“减小”或“不变”) 。
N2(g)+2NO2(g)反 应的平衡常数Kp=_______MPa-1 (Kp为以分压表示的平衡常数)。若升高温度,该反应的平衡常数Kp将______ (填“增大”、“减小”或“不变”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对3A2(g)+B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的

A. a、b、c三点平衡常数的大小关系为:Kb>Kc >Ka
B. 达到平衡时B2的转化率大小为:b>a>c
C. 增大压强有利于AB3的生成,因此在实际生产中压强越大越好
D. 若起始量为![]() ,则在T2温度下,平衡时AB3的体积分数接近b点
,则在T2温度下,平衡时AB3的体积分数接近b点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com