
【题目】如图是用于制备乙酸乙酯的常见简易装置。请根据该装置回答下列问题:

(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是先向试管中加入一定量的________,然后边振荡边缓缓加入________,冷却后再加入一定量的冰醋酸,轻轻振荡使之混合均匀。
(2)制备乙酸乙酯的化学反应方程式为_______。生成的乙酸乙酯,其密度比水_____(填“大”或“小”)。
(3)浓硫酸的作用是____________。
(4)试管B内装入饱和碳酸钠溶液,写出除去乙酸时发生反应的化学方程式_________。
(5)与书中采用的实验装置的不同之处是本实验采用了球形干燥管代替了长导管,并将干燥管的末端插入了溶液中。在此处球形干燥管的作用有________。
【答案】乙醇 浓硫酸 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 小 催化剂、吸水剂 2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O 防倒吸
CH3COOCH2CH3+H2O 小 催化剂、吸水剂 2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O 防倒吸
【解析】
在浓硫酸环境下,乙醇和乙酸发生取代反应生成乙酸乙酯,但乙醇和乙酸具有挥发性,极易与水反应,故在最后安装防倒吸装置,试管中加入饱和碳酸钠。
(1)浓硫酸绝对不能第一个加入,在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是先向试管中加入一定量的乙醇,然后边振荡边缓缓加入浓硫酸,冷却后再加入一定量的冰醋酸,轻轻振荡使之混合均匀。
(2)制备乙酸乙酯的化学反应方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O。生成的乙酸乙酯,其密度比水小。
CH3COOCH2CH3+H2O。生成的乙酸乙酯,其密度比水小。
(3)酯化反应是可逆反应,浓硫酸的作用是催化剂、吸水剂。
(4)试管B内装入饱和碳酸钠溶液,除去乙酸时发生反应的化学方程式为2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O。
(5)与书中采用的实验装置的不同之处是本实验采用了球形干燥管代替了长导管,并将干燥管的末端插入了溶液中。球形干燥管内容量大,在此处的作用为防倒吸。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】(1)某实验小组同学进行如图所示实验,以检验化学反应中的能量变化。


实验发现,反应后①中的温度升高,②中的温度降低。由此判断铝条与盐酸的反应是______热反应,Ba(OH)2·8H2O与NH4Cl的反应是______热反应。反应_____(填①或②)的能量变化可用图(b)表示。
(2)一定量的氢气在氧气中充分燃烧并放出热量。若生成气态水放出的热量为Q1,生成液态水放出的热量为Q2,那么Q1______(填大于、小于或等于)Q2。

(3)已知:4HCl+O2=2Cl2+2H2O,该反应中,4 mol HCl被氧化,放出115.6 kJ的热量,则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为______ kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用CO2为初始反应物,合成一系列重要的化工原料。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H1
NH2COONH4(s) △H1
反应Ⅱ:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol
CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H3=-86.98kJ/mol 请回答下列问题:
CO(NH2)2(s)+H2O(g) △H3=-86.98kJ/mol 请回答下列问题:
①根据8电子稳定构型,写出 CO(NH2)2的结构式_________________。
②反应Ⅰ的△H1=______________。
③在____(填“高温”或“低温”)情况下有利于反应Ⅱ的自发进行。
④一定温度下,在体积固定的密闭容器中按 n(NH3):n(CO2)=2:1 进行反应Ⅰ,下列能说明反应Ⅰ达到了平衡状态的是_______(填序号)。
A.混合气体的平均相对分子质量不再变化
B.容器内气体总压强不再变化
C.NH3与CO2的转化率相等
D.容器内混合气体的密度不再变化
(2)将CO2和H2按质量比25:3充入一定体积的密闭容器中,在不同温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。

①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为K(Ⅰ)_____K(Ⅱ)(填“ >”“<”或“=”)。
②欲提高CH3OH的平衡产率,可采取的措施除改变温度外,还有__________________(任写两种)。
③一定温度下,在容积均为2L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物起始投入量 | 1molCO2、3molH2 | a molCO2、bmolH2、cmolCH3OH(g) |
c mol H2O(g) (a、b、c 均不为零) | ||
若甲容器平衡后气体的压强为开始的 5/6,则该温度下,反应的平衡常数为__________,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,乙容器中 c 的取值范围为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示。下列说法正确的是
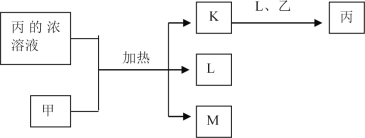
A. 原子半径:W<X<Y B. 元素的非全属性:Z>Y>X
C. 化合物XYZ中只含共价键 D. K、L、M中沸点最高的是M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列五种溶液:盐酸、NH3·H2O、NH4HSO4、NaOH、CH3COOH。回答下列问题:
(1)将1 L pH=2的HCl溶液分别与0.01 mol· L-1的NH3· H2O溶液x L、0.01 mol· L-1的NaOH溶液y L充分反应至中性,x、y大小关系为: y_____x(填“>”“<”或“=”)。
(2)H+浓度相同的等体积的两份溶液:盐酸和CH3COOH,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是_____(填写序号)。
①反应所需要的时间CH3COOH >HCl
②开始反应时的速率HCl>CH3COOH
③参加反应的锌粉物质的量HCl=CH3COOH
④反应过程的平均速率CH3COOH>HCl
⑤HCl溶液里有锌粉剩余
⑥CH3COOH溶液里有锌粉剩余
(3)将等体积、等物质的量浓度的NH3·H2O和NH4HSO4溶液混合后,升高温度(溶质不会分解)溶液pH随温度变化如图中的______曲线(填写序号)。

(4)室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加0.01 mol·L-1 NaOH溶液至中性,得到的溶液中:c(Na+)+c(NH4+) ______2c(SO42- )(填“>”“=”或“<”);用NH4HSO4与氢氧化钡溶液制取硫酸钡,若溶液中SO42- 完全沉淀,则反应后溶液的pH______7(填“>”“=”或“<”),该反应的离子方程式为_______________。
(5)25 ℃时,将a mol NH4NO3溶于水,溶液显酸性,原因是________________(用离子方程式表示)。向该溶液滴加b L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将_______(填“正向”“不”或“逆向”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年12月,华为宣布: 利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如图所示。下列关于该电池的说法不正确的是
C6+LiCoO2,其工作原理如图所示。下列关于该电池的说法不正确的是

A. 该电池若用隔膜可选用质子交换膜
B. 石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
C. 充电时,LiCoO2极 发生的电极反应为: LiCoO2-xe-=Li1-xCoO2+xLi+
D. 废旧的该电池进行“放电处理”让Li+从石墨烯中脱出而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.02mol·L—1的HCN溶液与0.02mol·L—1的NaCN溶液等体积混合,已知混合溶液中C(CN-)<C(Na+),则下列关系中,正确的是:
A.C(Na+)>C(CN-)>C( H+)>C(OH-)
B.C(HCN)+C (CN-)=0.04mol·L-1
C.C(CN-)>C(HCN)
D.C(Na+)+C(H+)= C(CN-)+C(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g。试回答下列问题:

(1)电源中X电极为直流电源的________极。
(2)A中发生反应的离子方程式为________。
(3)B中开始电解一段时间后,溶液的pH如何变化_______(填:变大、变小或不变),若要使溶液恢复原状,可向溶液中加入适量的__________。
(4)写出以下电极反应式
①C中的Ag电极___________________.
②B中的阳极______________________.
(5)通电5min时,B中共收集224mL(标准状况下)气体,溶液体积为200mL,则通电前CuSO4溶液的物质的量浓度为(设电解前后溶液体积无变化)__________。
(6)若电解中的直流电源为甲烷燃料电池(KOH为电解质),则电池的负极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】装置甲、乙、丙都是铁与水蒸气反应的实验装置,下列说法不正确的是
装置甲 装置乙
装置乙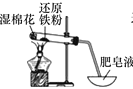 装置丙
装置丙
A.选用丙装置,实验结束时先移去酒精灯,再将导气管拿出水面
B.甲装置中氯化钙的作用是除去氢气中混有的水蒸气
C.用乙装置实验时,蒸发皿中产生大量肥皂泡,点燃肥皂泡发出爆鸣声
D.三个装置相比较,乙装置简单、操作简便、节约原料、安全性好
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com