
����Ŀ��Ϊ�˼������ˮ��IJ���������ʵ�鷽����
![]()
��ش��������⣺
��1���Լ�1Ϊ20%��H2SO4��Һ����������_________��
��2���Լ�2Ϊ_________����������_________��ʹ����ˮ������ʵ�����˳�����У�������Ӧ�����ӷ���ʽΪ��_________��
��3����Ӧ�ٵĻ�ѧ����ʽΪ_________��
��4��Ϊ�������Һ�Ƿ�����ȫˮ�⣬ȡ����ˮ��Һ���Թ��У������ˮ����֤������δ��ȫˮ���������_________��
��5�����ʵ�������û�м����Լ�2��ֱ�Ӽ����Լ�3���ܷ�ʵ��ʵ��Ŀ��_________���������������������������ܣ���ԭ����_________����ĸ�����ʩ��_________��
���𰸡������� ����������Һ �к������������� H++OH��=H2O (C6H10O5)n+nH2O![]() nC6H12O6 ��Һ����ɫ �� �������ܽ�Cu(OH)2��ʹʵ��ʧ�� ֱ������Һ�м����Թ�����NaOH��Һ
nC6H12O6 ��Һ����ɫ �� �������ܽ�Cu(OH)2��ʹʵ��ʧ�� ֱ������Һ�м����Թ�����NaOH��Һ
��������
��������Ϣ��֪�����������������·���ˮ�⣬ˮ��Һ���Ӽ��кͺ��ټ������Ƶ�������ͭ�����ȣ����Եõ�ש��ɫ������˵������ˮ�������������ǡ�
��1���Լ�1Ϊ20%��H2SO4��Һ���������Ǵ����������۷���ˮ�⣻
��2���Լ�2Ϊ����������Һ�����������к������������ᣬ��ֹ����ź�����ʵ�飬ʹ����ˮ������ʵ�����˳�����У�������Ӧ�����ӷ���ʽΪ��H++OH��=H2O��
��3����Ӧ��Ϊ����ˮ�����������ǣ��仯ѧ����ʽΪ(C6H10O5)n+nH2O![]() nC6H12O6��
nC6H12O6��
��4��ȡ����ˮ��Һ���Թ��У������ˮ��������ˮ��Һ��������֤������δ��ȫˮ�⣻
��5�����������ǵķ�Ӧ�����ڼ��������½��У����ʵ�������û�м����Լ�2��ֱ�Ӽ����Լ�3������ʵ��ʵ��Ŀ�ģ���ԭ�����������ܽ�Cu(OH)2��ʹʵ��ʧ�ܣ���ĸ�����ʩ�ǣ�ֱ������Һ�м����Թ�����NaOH��Һ��


 �ο�������ϵ�д�
�ο�������ϵ�д� ������ѧ��ʱ��ҵϵ�д�
������ѧ��ʱ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���������İ���������������Ƶ��ܱ����������![]() ��������������䣬��������������Բ���
��������������䣬��������������Բ���![]() ��ʹ��ﵽ�ֽ�ƽ�⣺
��ʹ��ﵽ�ֽ�ƽ�⣺![]() ��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
��ʵ���ò�ͬ�¶��µ�ƽ�����������±���
�¶� |
|
|
|
|
|
ƽ��������Ũ�� |
|
|
|
|
|
�����й�������ȷ����
A.�ÿ��淴Ӧ�ﵽƽ��ı�־֮һ�ǻ������ƽ����Է�����������
B.��÷�Ӧ![]() ��
��![]() �������ڵ������Է�����
�������ڵ������Է�����
C.�ﵽƽ������ں�����ѹ�������������ϵ�������Ũ������
D.���ݱ������ݣ�����![]() ʱ�ķֽ�ƽ�ⳣ��ԼΪ
ʱ�ķֽ�ƽ�ⳣ��ԼΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ����ֳЭ����������һ�����õ绯ѧԭ�����������ˮ�ʵķ�������װ����ͼ��ʾ������˵����ȷ����
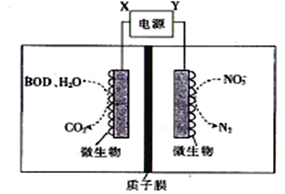
A. XΪ��Դ����
B. ����װ���ڸ����½��У���Ч�ʽ�����
C. ����1molNO3-����ԭ������6molH+ͨ������ĤǨ����������
D. ��BODΪ������(C6H12O6)����1mol�����DZ���ȫ����ʱ�������ϵ缫����20 mol e-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���������������ϴ���(��Ҫ�ɷ�ΪAl2O3������������Pd)����Al2(SO4)3��Pd���������£�

(1)Al2(SO4)3��Һ�������պ��������ʵĻ�ѧ������___________��
(2)����ʱAl2O3��(NH4)2SO4��Ӧ�Ļ�ѧ����ʽΪ___________��
ˮ�����кͲ���õ���Һ�IJ���������___________��
(3)��ҺY�к�PdԪ�ص�������___________ (�ѧʽ)��
(4)���Ȼ�ԭ����ÿ����1molPd���ɵ���������ʵ���Ϊ___________ (��֪�Ȼ�ԭ�õ��Ĺ���ֻ��Pd)��
(5)Pd�������Ĵ���������䴢��ԭ��Ϊ2Pd(s)+xH2(g)==2PdHx(s)������x�����ֵΪ0.8����֪�� Pd���ܶ�Ϊ12g��cm-3�� ��10.6cm3Pd�ܴ����״����H2��������Ϊ___________L��
(6)���������������ǽ�����Ϊ��������������ȵ��Һ�У�������-�ǻ����ᡢ����������е�⣬�ɹ۲쵽���ı�����γ�һ�����ܵ�����Ĥ��
��д�����ʱ�����ĵ缫��Ӧʽ��______________________ ��
�ڵ���������-�ǻ����ᡢ�����������ÿ�����______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȼ����ؿ���������������Ĺ�����Դ��һ���ȼ����صĻ����ṹ��ͼ��ʾ��������Ϊ����ʵ���ˮLiCl��KCl������������ں�ؼ���˲��������ܣ���ʱ����Ǧ�缫������Pb�������й�˵����ȷ����
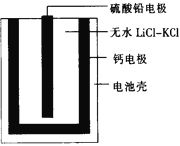
A. �������ʱ�����·�еĵ���������Ǧ�缫����Ƶ缫
B. �ŵ�ʱ�����LiCl��KCl�е�Li����Ƶ缫��Ǩ��
C. ����ܷ�ӦΪCa��PbSO4��2LiCl![]() Pb��Li2SO4��CaCl2
Pb��Li2SO4��CaCl2
D. ÿת��0.2 mol���ӣ�����������42.5 g LiCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��ȡ9.00g��������ˮ���ⶨ���۵�ˮ��ٷ��ʣ���������£�
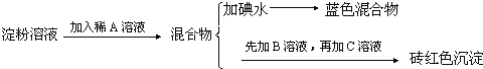
�Իش��������⣺
��1������������Լ�Ϊ��A_________��B_________��C_________��
��2������A��Һ��������B��Һ�Ƿ����_________����������_________��
��3��д������ˮ��ķ���ʽ_________��
��4��������1.44gש��ɫ����ʱ������ˮ������_________��[��֪��������Cu(OH)2��Ӧ�Ļ�ѧ����ʽΪ��CH2OH(CHOH)4CHO+2Cu(OH)2![]() CH2OH(CHOH)4COOH+Cu2O��+2H2O]��
CH2OH(CHOH)4COOH+Cu2O��+2H2O]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����(��)��ˮ����ȾˮԴ�����������պ����۶��������ٰ��䣬���뾭��������������ŷš��ൺij��ˮ�������Ĺ���������ͼ��
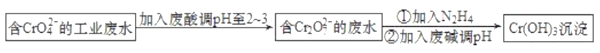
�ش��������⣺
��1��CrO42-�����Խ���������������ת��Ϊ���н�ǿ�����Ե�Cr2O72-�����ӷ���ʽΪ__��
��2����֪N2H4��Cr2O72-��Ӧ���������塣��Ҫ����Cr2O72-Ũ��Ϊ0.01mol��L-1�ķ�ˮ1m3��������Ҫ����N2H4__kg��
��3������SO32-�ķ�ˮ���Դ���N2H4�������Ժ���(��)��ˮ�������ӷ���ʽ��ʾ�䷴Ӧԭ��__��
��4��Cr(OH)3�Ļ�ѧ������Al(OH)3���ơ��������������ڼ���ϼ��pH��ʱҪ������Һ��pH���ܹ��ߣ�ԭ����__��
��5������(��)��ˮҲ���õ�ⷨ������������ʯī���缫�����ˮ��Cr2O72-��������ת��ΪCr3+�����ŵ��Ľ��У���ҺpH������Cr3+ת��ΪCr(OH)3������ȥ��
�ٸõ��װ������___��������������������Cr(OH)3���_������д��ѧʽ����
�������缫��ӦʽΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�IJ����Ǻ���һ������ʯ�ͻ���ˮƽ����Ҫ��־����ҵ�ϳ��ö����ѽ��Ʊ���ϩ��
����Ӧ��C4H10(g��������)![]() C2H4(g)+C2H6(g) ��H1
C2H4(g)+C2H6(g) ��H1
����Ӧ��C4H10(g��������)![]() CH4(g)+C3H6(g) ��H2
CH4(g)+C3H6(g) ��H2
�ش��������⣺
��1����ѧ�ϣ����ȶ����ʵ�������Ϊ0����Ԫ�صĵ��ʻ��ϳɵ�һ������ʱ�ķ�Ӧ�Ƚиû�����������ȣ������ȿɱ�ʾ����������������±�Ϊ25�桢101kPa�¶����л���������ȣ�
���� | ���� | ���� | ��ϩ | ��ϩ | ������ | �춡�� |
������/kJ��mol-1 | -75 | -85 | 52 | 20 | -125 | -132 |
��������Ӧ�У���H1=___kJ��mol-1��
�������Ը���Ӧ����ͬ�����²����춡���ѽ���ȡһ��������ϩ�����ܺıȲ���������__����������������������
��2��һ���¶��£��ں�ѹ�ܱ�������Ͷ��һ���������鷢����Ӧ������ϩ��
��������������÷�Ӧ�ﵽƽ��״̬����___������ţ���
a.�����ܶȱ��ֲ���
b.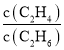 ���ֲ���
���ֲ���
c.��H����
d.������ֽ����ʺ����������������
��Ϊ��ͬʱ��߷�Ӧ���ʺ�ת���ʣ��ɲ��õĴ�ʩ��__��
��3�����ܱ������г��붡�飬��һ��������Ũ�ȡ�������ѹǿ�ȣ��·�����Ӧ�������ϩ�������¶ȹ�ϵ��ͼ��ʾ��
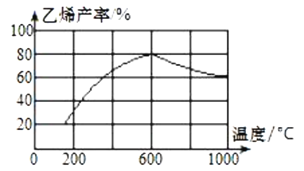
�¶ȸ���600��ʱ�������¶����ߣ���ϩ���ʽ��ͣ����ܵ�ԭ����__��
��4����һ���¶�����1L�����ܱ������г���2mol�����飬������ѹǿΪP0����Ӧ������ϩ�����飬����10min�ﵽƽ��״̬�����¶����ø���ֵķ�ѹ��ʾ��ƽ�ⳣ��K(p)=0.5P0��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������������0��10min����ϩ����������v(C2H4)Ϊ__mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��W��X��Y��Z��ԭ��������������X��ԭ�Ӱ뾶�����ж���������Ԫ�������ģ�W�ĺ����������X��Z������������֮����ȣ�Y��ԭ��������Z��������������2������W��X��Y����Ԫ���γɵĻ�����M�Ľṹ��ͼ��ʾ������˵���������
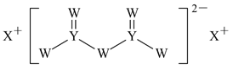
A.��̬�⻯����ȶ��ԣ�Z��Y
B.W��Y�γɵľ���Ϊ���۾���
C.Y���ʵ��۵����X����
D.������M��W��Y������8�����ȶ��ṹ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com