
【题目】已知A是一种气态烃,标况下的密度为1.25g/L,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
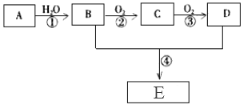
(1)写出A的结构简式 。
(2)B、D分子中所含官能团的名称分别是 、 。
(3)物质B可以直接氧化为D,需要加入的试剂是 。
(4)写出下列反应的化学方程式:
反应②的化学方程式: ;反应类型: 。
反应④的化学方程式: ;反应类型: 。
(5)B可由含淀粉的农产品如玉米、小麦、薯类等经发酵、蒸馏而得。请写出淀粉水解的化学方程式。
____________________________________________。
【答案】(1)CH2=CH2 (1分) (2)羟基 羧基 (各1分)
(3)酸性KMnO4溶液或酸性K2CrO7溶液(答案合理即可)(1分)
(4)2CH3CH2OH+O2![]() 2CH3CHO+2H2O (2分)催化氧化(或氧化)(1分)
2CH3CHO+2H2O (2分)催化氧化(或氧化)(1分)
CH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O (2分)酯化反应 (或取代反应)(1分)
CH3COOC2H5+H2O (2分)酯化反应 (或取代反应)(1分)
![]() (2分)。
(2分)。
【解析】
试题分析:A是一种气态烃,标况下的密度为1.25g/L,则A相对分子质量是M=1.25g/L×22.4L/mol=28,所以A是乙烯,结构简式是CH2=CH2,乙烯与水发生加成反应产生的B是乙醇,乙醇催化氧化产生的C是乙醛,乙醛催化氧化产生的D是乙酸;乙醇与乙酸发生酯化反应产生的E是乙酸乙酯。(1)乙烯的结构简式是CH2=CH2;(2)B是乙醇,官能团是羟基;D是乙酸,分子中所含官能团是羧基;(3)物质B可以直接氧化为D,需要强氧化物的物质,需要加入的试剂是酸性KMnO4溶液或酸性K2CrO7溶液等;(4)反应②的化学方程式:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;反应类型:氧化反应。反应④的化学方程式:CH3COOH+CH3CH2OH
2CH3CHO+2H2O;反应类型:氧化反应。反应④的化学方程式:CH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O;反应类型:酯化反应 (或取代反应);(5)乙醇可由含淀粉的农产品如玉米、小麦、薯类等水解产生葡萄糖,葡萄糖氧化产生乙醇。淀粉水解的化学方程式是
CH3COOC2H5+H2O;反应类型:酯化反应 (或取代反应);(5)乙醇可由含淀粉的农产品如玉米、小麦、薯类等水解产生葡萄糖,葡萄糖氧化产生乙醇。淀粉水解的化学方程式是![]() 。
。


科目:高中化学 来源: 题型:
【题目】某化学小组用右图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )
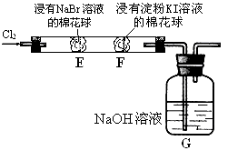
A.E处棉花球变成黄色,说明Cl2的氧化性比Br2强
B.F处棉花球变成蓝色,说明Br2的氧化性比I2强
C.E处发生反应的离子方程式为:Cl2+ 2Br-=2Cl-+ Br2
D.G装置中NaOH溶液与Cl2反应的离子方程式为:2OH- + Cl2 = ClO-+ Cl-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对化学工业和国防工业具有重要意义,对农业生产起着重要作用。
(1)已知:N2(g)+O2(g)=2NO(g) △H1
H2(g)+1/2O2(g)=H2O(1) △H2
4NH3(g)+5O2(g)=4NO(g)+6H2O(1) △H3
N2(g)+3H2(g)2NH3(g) △H4<0
则△H4= (用含△H1、△H2、△H3的代数式表示)。
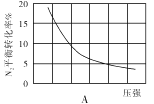
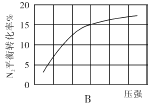
(2)在其他条件相同时,分别测定合成氨反应中N2的平衡转化率随压强变化的曲线如下图A、B所示,其中正确的是 (填“A”或“B”),其判断理由是 。
(3)在体积为2L的密闭容器中按物质的量1:3的比例充入N2、H2,进行下列四组合成氨实验:
组别 | 温度 | N2起始量/mol | N2的物质的量/mol | ||||||
5(s) | 10(s) | 15(s) | 20(s) | 25(s) | 30(s) | 35(s) | |||
Ⅰ | T1 | 0.1 | 0.094 | 0.089 | 0.085 | 0.0825 | 0.081 | 0.080 | 0.080 |
Ⅱ | T2 | 0.1 | 0.090 | 0.085 | 0.082 | 0.080 | 0.080 | 0.080 | 0.080 |
Ⅲ | T3 | 0.2 | 0.179 | 0.165 | 0.153 | 0.146 | x | x | x |
Ⅳ | T4 | 0.2 | 0.173 | 0.161 | 0.155 | 0.150 | 0.150 | 0.150 | 0.150 |
①实验Ⅰ前10秒的平均速率v(NH3)= mol·L-1·s-1,T1温度下合成氨反应的平衡常数K= (列出计算式)。
②与实验Ⅰ相比,实验Ⅱ改变了一个条件,该条件可能是 。
③与实验I相比,实验Ⅲ中N2的平衡转化率 (填“增大”、“减小”或“不变”),平衡常数K (填“增大”、“减小”或“不变”)。
④实验Ⅲ与实验Ⅳ的反应条件温度不同,则T1 (填“大于”、“小于”或“等于”)T2,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+1/x Sx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/x Sx(s) △H=bkJ/mol。
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是 。
(2)雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3可以和浓HNO3反应,当生成0.6mol的H3AsO4时,反应中转移电子的数目为3NA,则As2S3和浓HNO3反应的方程式是
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS、S2的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
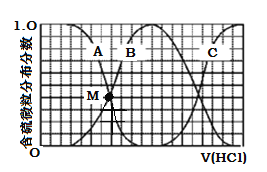
①曲线B表示 的分布分数。
②滴加过程中,溶液中微粒浓度大小关系正确的是 (填字母)。
A.c(Na+)= c(HS)+2c(S2)
B.3c(H2S)+2c(HS)+c(S2)+c(H+)=c(OH)
C.3c(Na+)=[c(H2S)+c(HS)+c(S2)]
③NaHS溶液呈碱性,当滴加盐酸至M点(A、B曲线的交叉点)时,溶液中各离子浓度由大到小的顺序为
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
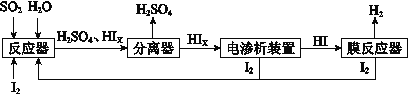
①写出反应器中发生反应的化学方程式是 。
②电渗析装置如下图所示
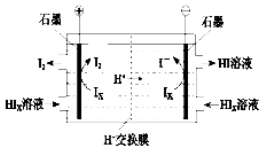
写出阳极的电极反应式 。
该装置中发生的总反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关非金属及其化合物的说法正确的是( )
A. 硅酸可使紫色石蕊试液变红色
B. 二氧化硫通入紫色石蕊试液中.试液先变红后褪色
C. 可用锌粒与稀硝酸反应制备氢气
D. 液溴易挥发,所以存放液溴的试剂瓶中应加水封保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法没有科学性错误的是 ( )
A. “白雪牌”漂白粉可令所有有色物质黯然失“色”,没有最白,只有更白
B. CO有毒,生有煤炉的居室,可放置数盆清水,这样可有效地吸收CO,防止煤气中毒
C. 氯化钙具有吸水性和潮解性,夏日里用它的水溶液喷洒柏油路,可有效地保护路面
D. 氯元素有毒,禁止放入口中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式K= 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)830℃,在1L的固定容器的密闭容器中放入1 mol CO和5 mol H2O,反应达平衡后,其化学平衡常数K 1.0(填“大于”、“小于”或“等于”)
(4)830℃,容器中的反应达到平衡。在其他条件不变的情况下,扩大容器的体积,平衡 移动。(填“向正方向”、“向逆方向”或“不”)
(5)若1200℃时,在某时刻该容器中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为 (选填“正反应方向”、“逆反应方向”、“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R有如下反应:RO3-+5R-+6H+=3R2+3H2O,下列说法正确的是
A.元素R位于周期表中第ⅦA族
B.RO3-中的R只能被还原
C.R2在常温常压下一定是气体
D.每反应消耗1 mol RO3-,转移电子的物质的量为5 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com