
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加。A是元素Y的单质。常温下,甲的浓溶液具有脱水性,和A发生钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙是无色刺激性气味气体。上述物质的转化关系如图所示。下列说法正确的是( )
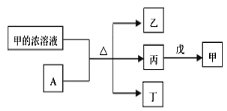
A.丁和戊中所含元素种类相同
B.简单离子半径大小:X<Y
C.气态氢化物的还原性:X>Z
D.Y的简单离子与Z的简单离子在水溶液中可大量共存
科目:高中化学 来源: 题型:
【题目】自然界中含锰元素的主要矿物有软锰矿(MnO2·xH2O)、黑锰矿Mn3O4,大洋底部有大量锰结核矿。锰元素在多个领域中均有重要应用,用于制合金,能改善钢的抗冲击性能等。
(1)Mn在元素周期表中位于___区,核外电子占据最高能层的符号是___,金属锰可导电,导热,具有金属光泽,有延展性,这些性质都可以用“___理论”解释。
(2)Mn3+在水溶液中容易歧化为MnO2和Mn2+,下列说法合理的是___。
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn2+中不含成对电子
C.第四周期元素中,锰原子价电子层中未成对电子数最多
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(3)在K2MnF6中,MnF62-的空间构型是正八面体,则中心原子的价层电子对数为__。该化合物中含有的共价键在形成过程中原子轨道的重叠方式为__。
(4)二价锰的化合物MnO和MnS熔融态均能导电,熔点MnO___MnS(选填“高于”、“等于”、“低于”)并解释原因___。
(5)某锰氧化物的晶胞结构如图:
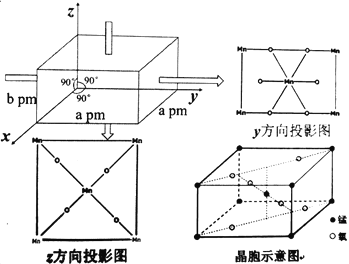
该锰的氧化物的化学式为___,该晶体中Mn的配位数为____,该晶体中Mn之间的最近距离为___pm(用a、b来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅在地壳中的含量较高,在自然界中硅主要以硅的氧化物和硅酸盐的形式存在。高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。下图为一种工业上提纯硅的路线:
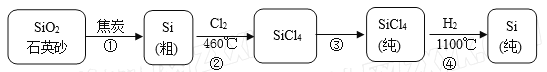
相关信息如下:
a.硼、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
b.有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | FeCl3 | PCl5 | Si | SiH4 |
沸点/℃ | 57.7 | 12.8 | 315 | — | 2355 | -111.9 |
熔点/℃ | -70.0 | -107.2 | — | — | 1410 | — |
升华温度/℃ | — | — | 300 | 162 | — | — |
请回答下列问题:
(1)SiCl4的电子式:________________;
(2)写出①的化学方程式________________________________________;
(3)①SiO2是硅酸盐玻璃的主要成分,盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,写出发生反应的离子方程式 ______________________________________________________________
②硅能与NaOH溶液反应,但同主族元素金属锗(Ge)不易溶于NaOH溶液,但有H2O2存在时,锗能与NaOH溶液反应生成锗酸盐,请写出化学反应方程式 ______________________________________________________________
(4)用强还原剂LiAlH4在乙醚介质中还原SiCl4,制得高纯度的甲硅烷SiH4,SiH4极易水解生成SiO2·nH2O和另一种气体。写出SiH4水解的化学反应方程式 __________________________________________________________________
(5)下列有关含硅材料说法正确的是_______________ (填字母)
A. 沸点:SiCl4 > SiH4
B. 金刚砂的有效成分是氮化硅,硬度大、熔点高,可用于制作高温陶瓷和轴承
C. 玻璃、陶瓷、水泥是广泛使用的三大新型硅酸盐材料
D. 人工制造的分子筛(一种具有均匀微孔结构的铝硅酸盐),主要用作吸附剂和催化剂等。
E. 锗、锡、铅的+4价氢氧化物的碱性强弱顺序:Ge(OH)4 < Sn(OH)4 < Pb(OH)4
6)粗硅中常含有铁、硼、磷等杂质,步骤②需在无氧无水环境下,控制温度在460℃左右得到SiCl4粗品,欲提纯SiCl4,步骤③采用的工艺方法依次是沉降、冷凝和_____________,需收集温度在_________℃左右的馏分。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:
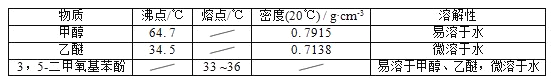
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取,①分离出甲醇的操作是的______;②萃取用到的分液漏斗使用前需__________________并洗净,分液时有机层在分液漏斗的________填(“上”或“下”)层;
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是__,用饱和食盐水洗涤的目的是______;
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__(填字母);
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先________________,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,可以用作染色工艺的还原剂,纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇,在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
(1)Na2S2O4在潮湿空气中氧化,生成的两种常见酸式盐是___(填化学式)。
(2)锌粉法制备Na2S2O4的工艺流程如图所示:
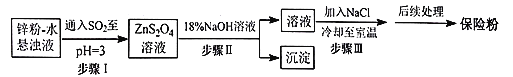
①工业上常将锌块进行预处理得到锌粉-水悬浊液,其目的是__。
②步骤Ⅰ中发生反应的化学方程式为__。
③在步骤Ⅲ中得到的Na2S2O4固体要用乙醇洗涤,其优点是__,“后续处理”最终要加入少量的Na2CO3固体,其原因是__。
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇水溶液中,然后通入SO2发生反应,有CO2气体放出,总反应的离子方程式是___。
(4)有人设计了图示方法同时制备连二亚硫酸钠和过二硫酸钠(Na2S2O8),并获得中国专利。电解过程中,阴极室生成Na2S2O4,a极的电极反应式为__,通过阳离子交换膜的离子主要是Na+,其迁移方向是__(填“a到b”或“b到a”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Fe2+、I-、Br-的混合溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是( )

A.线段Ⅱ表示Br-的变化情况
B.原溶液中n(FeI2):n(FeBr2)=3:1
C.根据图像无法计算a的值
D.线段Ⅳ表示HIO3的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性溶液中只有Na+、CH3OOO-、H+、OH-四种离子。则下列描述正确的是
A.该溶液可由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
B.该溶液可由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
C.加入NaOH,溶液中离子浓度可能为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是( )
A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与另外一种元素可形成共价化合物或离子化合物
C.S、Cl的含氧酸的酸性依次增强
D.用中文“![]() (ào)”命名的第118号元素在周期表中位于第七周期0族
(ào)”命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)ΔH=+Q kJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器进行该反应,下列叙述正确的是
Si(s)+4HCl(g)ΔH=+Q kJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器进行该反应,下列叙述正确的是
A.反应过程中,若增大压强因为反应速率增大,所以能提高SiCl4的转化率
B.已知一定温度下,反应的平衡常数(k)为定值,向已经达到平衡状态的容器中再次加入四种物质,若![]() >k,平衡就要向正反应方向移动
>k,平衡就要向正反应方向移动
C.反应至4 min时,若HCl的浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl可被100 mL 1 mol·L-1的NaOH溶液恰好完全吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com