
【题目】据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解质溶液为KOH溶液。下列有关该电池的叙述不正确的是
A. 正极反应式为:O2+2H2O+4e-=4OH-
B. 工作一段时间后,电解质溶液中KOH的物质的量不变
C. 该燃料电池的总反应方程式为:2H2+O2=2H2O
D. 用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:分析图像,以下结论错误的是
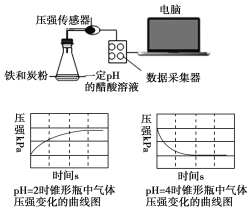
A.溶液pH≤2时,生铁发生析氢腐蚀
B.在酸性溶液中生铁可能发生吸氧腐蚀
C.析氢腐蚀和吸氧腐蚀的速率一样快
D.两溶液中负极反应均为:Fe-2e-===Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:碱存在下,卤代烃与醇反应生成醚(![]() ):
):
![]()
化合物![]() 经下列四步反应可得常用溶剂四氢呋喃,反应框图如下:
经下列四步反应可得常用溶剂四氢呋喃,反应框图如下:

![]() 、
、![]() 互为同分异构体,请回答下列问题:
互为同分异构体,请回答下列问题:
(1)![]() 和
和![]()
![]() 在一定条件下恰好反应,生成饱和一元醇
在一定条件下恰好反应,生成饱和一元醇![]() ,
, ![]() 的分子式为
的分子式为![]() ,
, ![]() 的结构简式为_________________。
的结构简式为_________________。
(2)第①③步反应类型分别为_______________反应,③_______________反应。
(3)化合物![]() 具有的化学性质(填写字母代号)是_______________。
具有的化学性质(填写字母代号)是_______________。
![]() 、可发生催化氧化反应
、可发生催化氧化反应
![]() 、与浓硫酸共热或与氢氧化钠的醇溶液共热均能发生消去反应
、与浓硫酸共热或与氢氧化钠的醇溶液共热均能发生消去反应
![]() 、可发生酯化反应
、可发生酯化反应
![]() 、催化条件下可发生加聚反应
、催化条件下可发生加聚反应
(4)核磁共振氢谱显示![]() 分子中有两种氢,写出
分子中有两种氢,写出![]() 的化学反应方程式:_______________。
的化学反应方程式:_______________。
(5)四氢呋喃(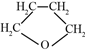 )有多种同分异构体,写出符合下列条件的结构简式____________。
)有多种同分异构体,写出符合下列条件的结构简式____________。
①链状 ②含有醚键 ③核磁共振氢谱显示有三种类型的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )

A. CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
B. CH3CH2OH(g )![]() CH2===CH2(g)+H2O(g) ΔH>0
CH2===CH2(g)+H2O(g) ΔH>0
C. 2C6H5CH2CH3(g)+O2(g) ![]() 2C6H5CH===CH2(g)+2H2O(g) ΔH<0
2C6H5CH===CH2(g)+2H2O(g) ΔH<0
D. CO2(g)+2NH3(g) ![]() CO(NH2)2(s)+H2O(g) ΔH<0
CO(NH2)2(s)+H2O(g) ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为该电池的工作原理示意图,该电池的电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定。请回答:
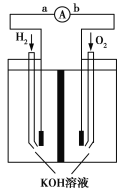
(1)氢氧燃料电池放电时能量转化形式主要是__________,在导线中电子流动方向为________(用a.b表示)。
(2)负极反应式为__________________。
(3)电极表面镀铂粉的原因为__________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.Li+H2![]() 2LiH
2LiH
Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是____________。
②知LiH固体的密度为0.82 g/cm3。用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________。
③将由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列有关图象,说法正确的是( )
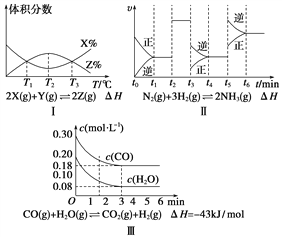
A. 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的ΔH<0
B. 由图Ⅱ知,反应在t6时刻,NH3体积分数最大
C. 由图Ⅱ知,t3时采取增大反应体系压强的措施
D. 若图Ⅲ表示在10 L容器、850℃时的反应,由图知,到4 min时,反应放出51.6 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,将amol N2与bmol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g), 已知反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol; 反应达平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的体积分数为25%。则:
2NH3(g), 已知反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol; 反应达平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的体积分数为25%。则:
(1)a的值为______。
(2)平衡时NH3的物质的量为___________。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)=___________________。
(4)原混合气体中,a∶b=________。
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)=________。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于反应:2SO2(g)+O2(g)![]() 2SO3 (g) ,下面表示该反应速率最快的是_______。
2SO3 (g) ,下面表示该反应速率最快的是_______。
A.v(SO2)= 2 mol/(L·min) B.v(O2)=1mol/(L·min)
C.v(O2)=2mol/(L·min) D.v(SO3)= 3mol/(L·min)
(2)下图表示在密闭容器中反应:2SO2(g)+O2(g)![]() 2SO3 (g) ΔH<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a b过程中改变的条件是______________;
2SO3 (g) ΔH<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a b过程中改变的条件是______________;
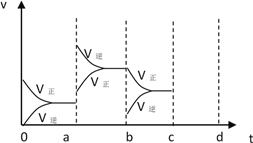
b c过程表示平衡向_______方向移动; 若增大压强时,反应速率变化情况画在下图c~d处______________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com