
【题目】火力发电厂释放出大量氮的氧化物(NOx)、二氧化硫等气体会造成环境污染,对燃煤废气进行脱除处理。可实现绿色环保、低碳减排、废物利用等目的。
(1)己知:N2 (g) +O2 (g) =2NO (g) △H=+180.5kJ·mol-1
C (s) +O2 (g)=CO2 (g) △H=-393.5 kJ·mol-1
2C (s) +O2(g) =2CO (g)△H=-221 kJ·mol-1
若某反应的平衡常数表达式为: 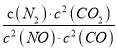 ,请写出此反应的热化学方程式_________。
,请写出此反应的热化学方程式_________。
(2)脱硝
利用甲烷与NO2反应,生成无污染的物质,则该反应的化学方程式为:___________。
(3)脱碳
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线(见如图1),则上述CO2转化为甲醇反应的△H3_____0(填“>”、“<”或“=”)。
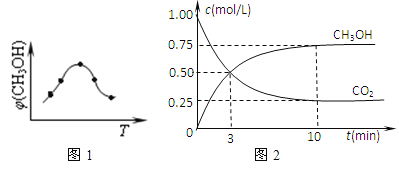
②在一恒温恒容密闭容器中充入0.5molCO2和1.5molH2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如上图2所示.请回答:第10min后,若升温,该反应的平衡常数将_____(填“变大”、“变小”、“不变”);若向该容器中再充入1molCO2和3molH2再次达到平衡时,则CH3OH(g)的体积分数将___(“变大”、“变小”、“不变”)。
(4)脱硫
某种脱硫工艺中将废气经处理后,与一定量的氨气、潮湿的空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.设烟气中的SO2、NO2的物质的量之比为1:1,则该反应的化学方程式为__________。若在0.1mol/L的硝酸铵溶液中加入等体积的0.09mol/L氨水,配制了pH=8.2的溶液,则该溶液中微粒浓度由大到小的顺序为______________。
【答案】 2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ/mol CH4 + 2NO2 = N2 + CO2 + 2H2O < 变小 变大 12NH3+3O2+4SO2+4NO2+6H2O=4(NH4)2SO4+4NH4NO3 c(NH4+)> c(NO3﹣)> c(NH3H2O)> c(OH﹣)>c(H+)
【解析】(1)因为反应的平衡常数为 ,所以反应方程式为2NO(g)+2CO(g)=N2(g)+2CO2(g)。将第二个方程式扩大2倍,减去第一个方程式,再减去第三个方程式皆可以得到上面的反应,该反应的△H=2×(-393.5)-180.5-(-221)=-756.5 kJ/mol,所以热化学方程式为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△ H=-746.5kJ/mol。
,所以反应方程式为2NO(g)+2CO(g)=N2(g)+2CO2(g)。将第二个方程式扩大2倍,减去第一个方程式,再减去第三个方程式皆可以得到上面的反应,该反应的△H=2×(-393.5)-180.5-(-221)=-756.5 kJ/mol,所以热化学方程式为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△ H=-746.5kJ/mol。
(2)甲烷与NO2反应,生成无污染的物质,一定是得到CO2、N2和H2O,根据化合价升降相等和原子个数守恒得到方程式为:CH4 + 2NO2 = N2 + CO2 + 2H2O。
(3)①该图像是发生上述反应,反应相同时间后,再测体系中甲醇的体积分数,即不一定是平衡状态的体积分数。当温度比较低的时候,反应速率比较慢,则这个时间点上还没有达平衡,那么反应的速率越快,反应的量越多,甲醇的体积分数越大;当温度较高的时候,反应速率比较快,则这个时间点上应该已经达到平衡态,那么随着温度变化对平衡产生影响,甲醇的体积分数也会变化。根据以上理论,图像中右半边温度较高的区域是平衡移动导致甲醇的体积变化,温度升高肌醇体积分数降低,说明升温平衡逆向移动,正反应放热,即△H3<0。
②该反应放热,升高温度平衡常数减小。恒容,原来加入0.5molCO2和1.5molH2,再充入1molCO2和3molH2,就是同时同比例增大所有反应物的浓度,甲醇体积分数的变化相当于不加入物质,直接增大压强,增大压强平衡向正反应方向移动,甲醇的体积分数增大。
(4)根据题目表述反应物为氨气、二氧化硫、一氧化氮、水,生成物一定有硫酸铵和硝酸铵,所以得到部分反应方程式:NH3+O2+SO2+NO2+H2O→(NH4)2SO4+NH4NO3,因为烟气中的SO2、NO2的物质的量之比为1:1,所以将两者视为一个整体,化合价升高3价(S升高2价,N升高1价),O2降低4价,所以O2的系数为3,SO2、NO2的系数都是4。最后根据原子个数守恒配平即得:12NH3+3O2+4SO2+4NO2+6H2O=4(NH4)2SO4+4NH4NO3。若在0.1mol/L的硝酸铵溶液中加入等体积的0.09mol/L氨水,则溶液中硝酸铵的浓度为0.05mol/L,一水合氨的浓度为0.045mol/L,即开始时可以认为:c(NH4+)= c(NO3﹣)=0.05mol/L, c(NH3H2O)=0.045mol/L。溶液的pH=8.2,说明一水合氨的电离占主导地位。一水合氨电离为铵根离子,所以c(NH4+)> c(NO3﹣)> c(NH3H2O),明显溶液中一水合氨的电离程度较小,氢氧根的浓度应该远小于一水合氨的浓度,溶液显碱性有:c(OH﹣)>c(H+),所以有:c(NH4+)> c(NO3﹣)> c(NH3H2O)> c(OH﹣)>c(H+)。


科目:高中化学 来源: 题型:
【题目】如图是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置。
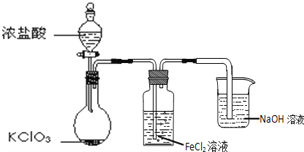
(1)NaOH溶液的作用是______。
(2)实验中,需控制氯气产生的速度,以便使FeCl2溶液转化完全。控制生成氯气速度的操作是______。
(3)开始反应后,在洗气瓶和烧杯所盛放的物质中,被氧化的是______(填化学式)。
(4)烧瓶中发生反应的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知反应2FeCl3+Cu=CuCl2+2FeCl2 , 则下列判断正确的是( )
A.该反应是置换反应
B.该反应中FeCl3作还原剂
C.还原性:Cu>Fe2+
D.氧化性:CuCl2>FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组欲设计实验验证Zn、Fe、Cu的金属活动性,他们提出了以下两种方案.请你帮助他们完成有关实验项目:
(1)用三种金属与盐酸反应的现象来判断,实验中除选择大小相同的金属片外,还需要控制________、________相同;若选用一种盐溶液验证三种金属的活泼性,该试剂________.
(2)①若用Zn、Cu作电极设计成原电池,并能产生持续稳定的电流,以确定Zn、Cu的活动性.试在下面方框中画出原电池装置图,标出原电池的电极材料和电解质溶液_______.

②上述装置中正极反应式为 ________.
③某小组同学采用Zn、Fe作为电极,只用一个原电池证明三种金属的活动性,则电解质溶液最好选用________.
A.0.5molL﹣1氯化亚铁溶液
B.0.5molL﹣1氯化铜溶液
C.0.5molL﹣1盐酸
D.0.5molL﹣1氯化亚铁和0.5molL﹣1氯化铜混合溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和。各溶液中Ba2+的浓度最小的为
A. 40mL 水 B. 10mL 0.2mol/LNa2CO3溶液
C. 50mL 0.01mol/L 氯化钡溶液 D. 100mL 0.01mol/L盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,几种弱酸的电离平衡常数如下:
弱酸 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)CH3COOH、H2CO3、H2SO3三种酸中酸性最弱的是__________(填化学式)。
(2)CH3COOH的电离平衡常数表达式为K=__________。
(3)写出H2CO3的第二步电离方程式:_____________。
(4)写出H2SO3溶液和CH3COONa溶液反应的离子方程式:____________________。
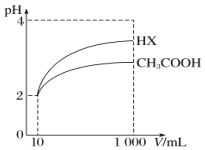
(5)将体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)醋酸的电离平衡常数,理由是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) ![]() Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
A. 若增大压强,则物质Y的转化率减小
B. 将容器体积变为20 L,Z的平衡浓度变为原来的![]()
C. 以X的浓度变化表示的反应速率为0.001 mol/(L·s)
D. 若升高温度,X的体积分数增大,则该反应的ΔH >0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是
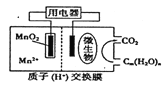
A. 正极反应式为MnO2+4H++2e-===Mn2++2H2O
B. 微生物所在电极区放电时发生还原反应
C. 放电过程中,H+从正极区移向负极区
D. 若用该电池给铅蓄电池充电,MnO2电极质量减少8.7g,则铅蓄电池阴极增重9.6g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com