
【题目】25℃时,几种弱酸的电离平衡常数如下:
弱酸 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)CH3COOH、H2CO3、H2SO3三种酸中酸性最弱的是__________(填化学式)。
(2)CH3COOH的电离平衡常数表达式为K=__________。
(3)写出H2CO3的第二步电离方程式:_____________。
(4)写出H2SO3溶液和CH3COONa溶液反应的离子方程式:____________________。
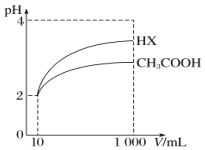
(5)将体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)醋酸的电离平衡常数,理由是__________________。
【答案】 H2CO3 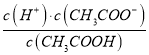 HCO3-
HCO3-![]() CO32-+H+ H2SO3+CH3COO-=HSO3-+CH3COOH 大于 pH值相同的醋酸溶液和HX溶液稀释相同的倍数时,HX的pH变化程度更大,则HX酸性更强,电离平衡常数更大
CO32-+H+ H2SO3+CH3COO-=HSO3-+CH3COOH 大于 pH值相同的醋酸溶液和HX溶液稀释相同的倍数时,HX的pH变化程度更大,则HX酸性更强,电离平衡常数更大
【解析】本题考查电离平衡常数、电离方程式的书写,(1)电离平衡常数越大,说明电离程度越大,三种酸酸性强弱的顺序是H2SO3>CH3COOH>H2CO3;(2)CH3COOH的电离:CH3COOH![]() CH3COO-+H+,依据电离平衡常数的表达式,即Ka=
CH3COO-+H+,依据电离平衡常数的表达式,即Ka=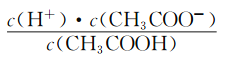 ;(3)碳酸是多元弱酸,其电离应是分步电离,电离方程式为H2CO3
;(3)碳酸是多元弱酸,其电离应是分步电离,电离方程式为H2CO3![]() H++HCO3-、HCO3-
H++HCO3-、HCO3-![]() H++CO32-或是H2CO3+H2O
H++CO32-或是H2CO3+H2O![]() H3O++HCO3-、HCO3-+H2O
H3O++HCO3-、HCO3-+H2O![]() H3O++CO32-,碳酸的第二步电离为:HCO3-
H3O++CO32-,碳酸的第二步电离为:HCO3-![]() H++CO32-或HCO3-+H2O
H++CO32-或HCO3-+H2O![]() H3O++CO32-;(4)根据上述表格数据,电离H+大小顺序是H2SO3>CH3COOH>HSO3-,利用电离平衡常数大的制备电离平衡常数小的,因此H2SO3和CH3COONa发生的离子反应是:H2SO3+CH3COO-=HSO3-+CH3COOH;(5)相同pH的两种酸,稀释相同倍数,酸性强的pH变化大,根据图像,稀释相同倍数,HX的pH变化大,因此HX的酸性强于CH3COOH。
H3O++CO32-;(4)根据上述表格数据,电离H+大小顺序是H2SO3>CH3COOH>HSO3-,利用电离平衡常数大的制备电离平衡常数小的,因此H2SO3和CH3COONa发生的离子反应是:H2SO3+CH3COO-=HSO3-+CH3COOH;(5)相同pH的两种酸,稀释相同倍数,酸性强的pH变化大,根据图像,稀释相同倍数,HX的pH变化大,因此HX的酸性强于CH3COOH。


科目:高中化学 来源: 题型:
【题目】从海水中可以提取溴,主要反应为:2Br﹣+Cl2=2Cl﹣+Br2 , 下列说法正确的是( )
A.溴离子具有氧化性
B.氯气是还原剂
C.氯气发生氧化反应
D.氧化性:Cl2>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】区别甲烷、乙烯、乙炔气体的最简易方法是
A. 分别通入溴水 B. 分别通入酸性高锰酸钾溶液
C. 分别在空气中燃烧 D. 分别通入盛有碱石灰的干燥管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火力发电厂释放出大量氮的氧化物(NOx)、二氧化硫等气体会造成环境污染,对燃煤废气进行脱除处理。可实现绿色环保、低碳减排、废物利用等目的。
(1)己知:N2 (g) +O2 (g) =2NO (g) △H=+180.5kJ·mol-1
C (s) +O2 (g)=CO2 (g) △H=-393.5 kJ·mol-1
2C (s) +O2(g) =2CO (g)△H=-221 kJ·mol-1
若某反应的平衡常数表达式为: 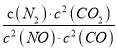 ,请写出此反应的热化学方程式_________。
,请写出此反应的热化学方程式_________。
(2)脱硝
利用甲烷与NO2反应,生成无污染的物质,则该反应的化学方程式为:___________。
(3)脱碳
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线(见如图1),则上述CO2转化为甲醇反应的△H3_____0(填“>”、“<”或“=”)。
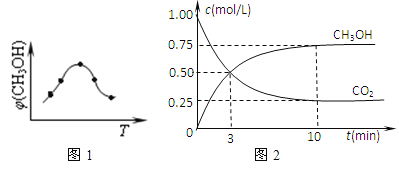
②在一恒温恒容密闭容器中充入0.5molCO2和1.5molH2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如上图2所示.请回答:第10min后,若升温,该反应的平衡常数将_____(填“变大”、“变小”、“不变”);若向该容器中再充入1molCO2和3molH2再次达到平衡时,则CH3OH(g)的体积分数将___(“变大”、“变小”、“不变”)。
(4)脱硫
某种脱硫工艺中将废气经处理后,与一定量的氨气、潮湿的空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.设烟气中的SO2、NO2的物质的量之比为1:1,则该反应的化学方程式为__________。若在0.1mol/L的硝酸铵溶液中加入等体积的0.09mol/L氨水,配制了pH=8.2的溶液,则该溶液中微粒浓度由大到小的顺序为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在工农业生产中应用广泛,可由N2、H2合成NH3。
(1)天然气蒸汽转化法是前获取原料气中H2的主流方法。CH4经过两步反应完全转化为H2和CO2,其能量变化示意图如下:

结合图像,写出CH4通过蒸汽转化为CO2和H2的热化学方程式______________________。
(2)利用透氧膜,一步即获得N2、H2,工作原理如图所示(空气中N2与O2的物质的量之比按4∶1计)
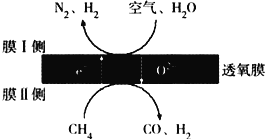
①起还原作用的物质是_________________________。
②膜I侧所得气体![]() =2,CH4、H2O、O2反应的化学方程式是______________________。
=2,CH4、H2O、O2反应的化学方程式是______________________。
(3)甲小组模拟工业合成氨在一恒温恒容的密闭容器中发生如下反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH< 0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是____________
2NH3(g) ΔH< 0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如图所示,下列说法正确的是____________

A.Ⅰ、Ⅱ两过程到达平衡时,平衡常数:KⅠ<KⅡ
B.Ⅰ、Ⅱ两过程到达平衡时,NH3的体积分数:Ⅰ<Ⅱ
C.Ⅰ、Ⅱ两过程到达平衡的标志:混合气体密度不再发生变化
D.t2时刻改变的条件可以是向密闭容器中加N2和H2混合气
(4)乙小组模拟不同条件下的合成氨反应,向容器充入9.0molN2和23.0molH2,图为不同温度下平衡混合物中氨气的体积分数与总压强(P)的关系图。
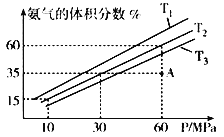
①T1、T2、T3由大到小的排序为______________________________。
②在T2、60MPa条件下,比较A点v正___v逆(填“>”、“<”或“=”),理由是____________。
③计算T2、60Mpa平衡体系的平衡常数Kp=__________。(用平衡分压代替平衡浓度计算,分压=总压x物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为工业从海水中提取液溴的流程图:
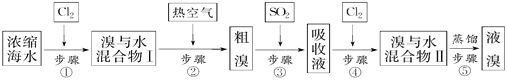
已知:溴的沸点为59 ℃,微溶于水,有毒性。请回答:
(1)某同学利用左下图装置进行步骤①至步骤④的实验,当进行步骤①时,应关闭活塞_______,打开活塞____________。
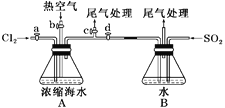
(2)步骤②中可根据____________________________现象,简单判断热空气的流速。
(3)步骤③中简单判断反应完全的依据是___________________________。
(4)从“溴水混合物Ⅰ”到“溴水混合物Ⅱ”的目的是___________________________。
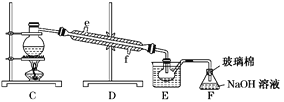
(5)步骤⑤用右上图装置进行蒸馏,蒸馏烧瓶中尚未安装温度计,安装其位置时应注意_____,装置C中直接加热不合理,应改为______,蒸馏时冷凝水应从______端进入(填“e”或“f”),图中E、F的作用是________________、__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是化合反应的是( )
A.灼热的碳与二氧化碳反应B.铝片与稀硫酸的反应
C.甲烷在氧气中的燃烧D.Ca(OH)2溶液与足量CO2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Hg 是水体污染的重金属元素之一。水溶液中的二价汞的主要存在形态与Cl-、OH-的浓度关系如图所示[图中涉及的物质或粒子只有Hg(OH)2 为难溶物,粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-1gc(Cl-)]:

下列说法中错误的是
A. Hg(NO3)2固体溶于水通常会出现浑浊
B. 海水Cl-的浓度大于0.1mol/L,则其中汞元素的主要存在形态是Hg(OH)2
C. 少量Hg(NO3)2溶于0.001moL/L盐酸后得到澄清透明溶液
D. 已知Ksp(HgS)=1.6×10-52,当c(S2-)=1×10-5mo/L 时,c(Hg2+)=1.6×10-47mo/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com