
【题目】为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如图所示。

请填写下列空白:
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用:__________。己知氯化炉中反应的氧气和焦炭的理论用料物质的量比为7:6,则氯化炉中发生的化学方程式为:___________。其中还原剂的化学式是__________。
(2)氩气(Ar)通入还原炉中并不参与反应,通入Ar气的作用是:__________。
已知TiC14 和Mg反应时放热,则反应物的总能量______(填“大于”或“小于”或者“等于”) 生成物的总能量。
(3)以甲醇(CH3OH)、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式为_________。标准状况下,通入11.2LO2并完全反应后,有______mol电子转移。工作一段时间后,测得溶液的pH____(填“减小”、“增大”或“不变”)。
【答案】 增大反应物间接接触面积,提高反应速率 6C+2Cl2+2FeTiO3=6CO+2TiCl4+2FeCl3 C和FeTiO3 Mg和Ti都有强还原性,在Ar气氛围中可防止被氧化 大于 CH3OH-6e-+8OH-=CO32-+6H2O 2 减小
【解析】(1)粉碎反应物,可以增大其表面积,从而增大反应物之间的接触面积,提高反应速率;已知氯化炉中反应氯气和焦炭的理论用料物质的量比为7:6,则发生的反应为6C+2Cl2+2FeTiO3![]() 6CO+2TiCl4+2FeCl3,根据化合价变化可知,C和FeTiO3为还原剂;(2)氩气性质不活泼可以防止Mg和Ti等具有强还原性的物质被氧化,即作用是:Mg和Ti都有强还原性,在Ar气氛围中可防止被氧化;已知TiC14 和Mg反应时放热,则反应物的总能量大于生成物的总能量。(3)甲醇失去电子,则甲醇在负极通入,该电池中负极上的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O。标准状况下,通入11.2LO2即0.5mol氧气,并完全反应后,有0.5mol×4=2mol电子转移。由于反应中消耗强碱,则工作一段时间后,测得溶液的pH减小。
6CO+2TiCl4+2FeCl3,根据化合价变化可知,C和FeTiO3为还原剂;(2)氩气性质不活泼可以防止Mg和Ti等具有强还原性的物质被氧化,即作用是:Mg和Ti都有强还原性,在Ar气氛围中可防止被氧化;已知TiC14 和Mg反应时放热,则反应物的总能量大于生成物的总能量。(3)甲醇失去电子,则甲醇在负极通入,该电池中负极上的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O。标准状况下,通入11.2LO2即0.5mol氧气,并完全反应后,有0.5mol×4=2mol电子转移。由于反应中消耗强碱,则工作一段时间后,测得溶液的pH减小。


科目:高中化学 来源: 题型:
【题目】在无色溶液中,下列各组离子能大量共存的是
A.K+、SO42-、Cl-、NH4+ B.Na+、NO3-、Ag+、CO32-
C.Na +、Cl-、NO3-、Cu2+ D.K+、HCO3-、SO42-、OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列生活中常见的物质的俗名与化学式相对应的是( )
A.苏打﹣﹣NaHCO3
B.胆矾﹣﹣CuSO4
C.磁性氧化铁﹣﹣Fe3O4
D.生石灰﹣﹣CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,下列各种情况下一定能大量共存的离子组为
A.pH=7的溶液中:Fe3+、Cl-、Na+、NO![]()
B.由水电离出的c(H+)=1×10-13 mol·L-1的水溶液中Na+、CO![]() 、Cl-、K+
、Cl-、K+
C.无色透明的酸性溶液中NH![]() 、NO
、NO![]() 、Al3+、Cl-
、Al3+、Cl-
D.Al3+、HCO![]() 、I-、Ca2+
、I-、Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有HCO3﹣、SO32﹣、Cl﹣和Na+ , 若向其中通入足量的Cl2 , 溶液中上述四种离子的浓度基本保持不变的是( )
A.HCO3﹣
B.SO32﹣
C.Cl﹣
D.Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图,下列说法正确的是( )
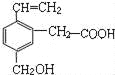
A. 该有机物的分子式为C11H15O3
B. 该有机物不能发生取代反应
C. 1 mol该物质与足量的钠反应可以生成1 mol氢气
D. 1 mol该有机物可以与1 mol碳酸钠发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物的描述正确的是( )
A.有机物是有生命的物质
B.有机物只能由动植物体内产生,不能用人工方法合成
C.凡是含碳元素的化合物都属于有机物
D.在所有的有机物中都含有碳,多数含有氢,其次还含有氧、氮、卤素、硫等。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com