
【题目】醇酸树脂是一种成膜性好的树脂,下面是一种醇酸树脂的合成线路:
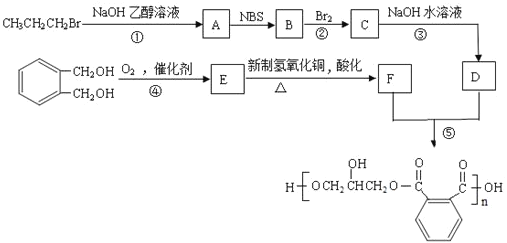
已知:RCH2CH=CH2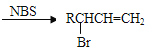
(1)写出B的结构简式是___。
(2)反应①~⑤中属于取代反应的是___(填序号)。
(3)写出由C→D的化学方程式___。
(4)写出由E与新制氢氧化铜反应的化学方程式___,现象___。
(5)下列说法正确的是___(填字母)。
a.1molE与足量的银氨溶液反应能生成2molAg
b.1molF能与足量的NaHCO3反应产生1molCO2
c.丁烷、1﹣丙醇和D中沸点最高的为D
(6)写出符合下列条件的与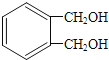 互为同分异构体的结构简式___。
互为同分异构体的结构简式___。
a.能与浓溴水反应生成白色沉淀
b.苯环上一氯代物有两种
c.能发生消去反应
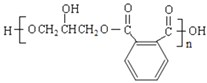
(7)反应⑤的化学方程式是___。
【答案】CH2=CHCH2Br ③⑤ CH2BrCHBrCH2Br+3NaOH![]() CH2OHCHOHCH2OH+3NaBr
CH2OHCHOHCH2OH+3NaBr 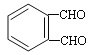 +4Cu(OH)2+2NaOH
+4Cu(OH)2+2NaOH![]()
 +2Cu2O↓+ 6H2O 生成砖红色沉淀 c
+2Cu2O↓+ 6H2O 生成砖红色沉淀 c 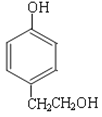 或
或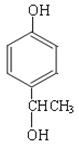
![]() →
→ +(2n-1)H2O
+(2n-1)H2O
【解析】
CH3CH2CH2Br在NaOH乙醇溶液发生消去反应生成A,A为CH3CH=CH2,根据已知信息可判断B为CH2=CHCH2Br,B与溴发生加成生成C,C为CH2BrCHBrCH2Br,C在NaOH水溶液发生水解生成D,D为丙三醇(CH2OHCHOHCH2OH)。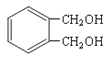 发生催化氧化生成E,E的结构简式为
发生催化氧化生成E,E的结构简式为 ,E被新制氢氧化铜氧化后酸化,生成F,F的结构简式为
,E被新制氢氧化铜氧化后酸化,生成F,F的结构简式为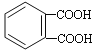 ,
, 和丙三醇发生缩聚反应生成高分子化合物
和丙三醇发生缩聚反应生成高分子化合物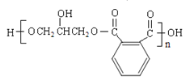 ,据此分析作答。
,据此分析作答。
(1)根据以上分析可知B的结构简式是CH2=CHCH2Br。
(2)根据以上分析可知反应①~⑤中属于取代反应的是③⑤。
(3)C→D为卤代烃的水解反应,其化学方程式为:CH2BrCHBrCH2Br+3NaOH![]() CH2OHCHOHCH2OH+3NaBr。
CH2OHCHOHCH2OH+3NaBr。
(4)E与新制氢氧化铜反应的化学方程式为 +4Cu(OH)2+2NaOH
+4Cu(OH)2+2NaOH ![]()
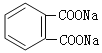 +2Cu2O↓+ 6H2O,现象为:生成砖红色沉淀。
+2Cu2O↓+ 6H2O,现象为:生成砖红色沉淀。
(5)a.E为 ,1 molE中含2mol醛基,则与足量的银氨溶液反应能生成4molAg,a项错误;
,1 molE中含2mol醛基,则与足量的银氨溶液反应能生成4molAg,a项错误;
b.F含有羧基,所以能与NaHCO3反应产生
c.丁烷、1-丙醇和丙三醇中,丁烷常温下为气体,1-丙醇和丙三醇为液体,且在碳原子数相同的情况下,羟基数越多,沸点越高,故沸点最高的为丙三醇,c项正确,
故答案为c;
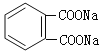
(6)a.能与浓溴水反应生成白色沉淀,说明含有酚羟基;b.苯环上一氯代物有两种;c.能发生消去反应,说明含有醇羟基且与醇羟基相连碳原子的邻碳上有H原子,则符合条件的同分异构体的结构简式为 或
或 。
。
(7)反应⑤是缩聚反应,反应的化学方程式是![]() →
→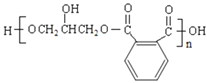 +(2n-1)H2O。
+(2n-1)H2O。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,22.4L氯仿中含有的氯原子数目为3NA
B.1mol羟基中含有的电子数为10NA
C.常温常压下,50gC7H16分子中含有的共价键数目为11NA
D.14g乙烯与2-丁烯混合物中含有碳原子数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述变化理论上计量结果正确的是( )
A. 标准状况下,用含空气和氨气体积各半的烧瓶进行喷泉实验,所得溶液的物质的量浓度约为![]()
B. 相同质量的两份铝,分别放入足量的![]() 和
和![]() 溶液中充分反应,消耗的
溶液中充分反应,消耗的![]() 和
和![]() 之比为1∶1
之比为1∶1
C. 将![]() 逐滴加入到
逐滴加入到![]() 溶液中,产生
溶液中,产生![]() 的体积约为
的体积约为![]() (标准状况下)
(标准状况下)
D. 向![]() 的
的![]() 溶液中通入足量的
溶液中通入足量的![]() 气体,生成
气体,生成![]() 沉淀
沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)甲醛与银氨溶液的反应的化学方程式:___;
(2)苯酚和碳酸钠反应的化学方程式:___;
(3)2-溴丙烷的消去反应方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. “84”消毒液中:SiO32-、CO32-、Na+、K+
B. ![]() 的溶液中NH4+、Ca2+、C1-、NO3-
的溶液中NH4+、Ca2+、C1-、NO3-
C. 0.1mol/LNaA1O2溶液中:HCO3-、NH4+、SO32-、Fe3+
D. pH=1的溶液中:Na+、K+、Cl-、S2O32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰。海水冻结时,部分来不及流走的盐分以卤汁的形式被包围在冰晶之间,形成“盐泡”![]() 假设盐分以一个NaCl计
假设盐分以一个NaCl计![]() ,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )
,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )

A.海冰内层“盐泡”越多,密度越小
B.海冰冰龄越长,内层的“盐泡”越多
C.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
D.海冰内层NaCl的浓度约为![]() 设冰的密度为
设冰的密度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:

I.图一中A为教材制备乙酸乙酯的实验装置,甲同学认为图一中B装置比A要好,则冷却水应从______口进入;乙同学认为图一中C装置效果更好,理由是_______。
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)26H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)[提出猜想]小组同学认为分解产物可能有以下几种情况:
A.Fe2O3、SO2、NH3、H2O B.FeO、SO3、NH3、H2O
C.FeO、SO2、NH3、H2O D.Fe2O3、SO3、SO2、NH3、H2O
根据所学知识,可确定_________不成立(填序号)
(2)[药品验纯]甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和_________溶液检验出“摩尔盐”中的三种离子;取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加_______(填试剂名称和实验现象),则“摩尔盐”未因氧化而变质。
(3)[实验探究]为检验分解产物,甲同学设计了如下实验装置。
①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是________。
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀.C中发生反应的离子方程式为________。
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含______。
(4)[实验结论与反思]通过实验现象和认真反思,上述猜想中一定正确的是______。(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图是一个化学过程的示意图。
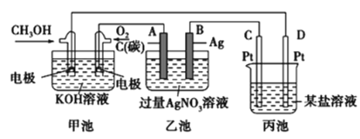
①乙池中总反应的离子方程式____________。
②电解一段时间后,向乙池的溶液中加入________________可恢复为原溶液。
③当乙池中B(Ag)极的质量增加5.40g,此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是________。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
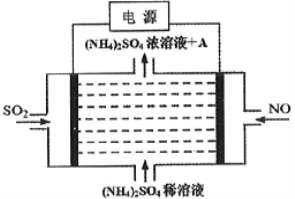
(2)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:

①写出负极的电极反应式:___________。
②图中X溶液是________。
③利用图中设计的原电池为电源可将雾霾中的NO、SO2电解分别转化为NH4+和SO42-,如图所示,则物质A的化学式为_____________,阴极的电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若R元素原子的质量数为A,Rm-的核外电子数为x,则w g Rm-所含中子的物质的量为( )
A.(A-x+m) molB.(A-x-m) mol
C.![]() (A-x+m) molD.
(A-x+m) molD.![]() (A-x-m) mol
(A-x-m) mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com