
【题目】化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:

I.图一中A为教材制备乙酸乙酯的实验装置,甲同学认为图一中B装置比A要好,则冷却水应从______口进入;乙同学认为图一中C装置效果更好,理由是_______。
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)26H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)[提出猜想]小组同学认为分解产物可能有以下几种情况:
A.Fe2O3、SO2、NH3、H2O B.FeO、SO3、NH3、H2O
C.FeO、SO2、NH3、H2O D.Fe2O3、SO3、SO2、NH3、H2O
根据所学知识,可确定_________不成立(填序号)
(2)[药品验纯]甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和_________溶液检验出“摩尔盐”中的三种离子;取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加_______(填试剂名称和实验现象),则“摩尔盐”未因氧化而变质。
(3)[实验探究]为检验分解产物,甲同学设计了如下实验装置。
①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是________。
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀.C中发生反应的离子方程式为________。
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含______。
(4)[实验结论与反思]通过实验现象和认真反思,上述猜想中一定正确的是______。(填序号)
【答案】b 既能冷凝回流又能及时分离出反应生成的水,有利于酯的生成 C Ba(OH)2 硫氰化钾溶液,溶液不变红色 使分解产生的气体在B、C中被吸收充分 SO2+H2O2+Ba2+=BaSO4↓+2H+ FeO A
【解析】
I.为充分冷凝蒸气,冷却水的流向和蒸气的流向应该相反,所以冷却水应从b口进入;C装置既能冷凝回流又能及时分离出反应生成的水,有利于酯的生成。故答案为b,既能冷凝回流又能及时分离出反应生成的水,有利于酯的生成。
Ⅱ.(1)A. “摩尔盐”中铁的化合价为+2价,硫为+6价,生成物中铁为+3价,硫为+4价,化合价既有升高又有降低,所以A合理;
B.没有任何一种元素的化合价发生变化,所以B合理;
C.只有硫的化合价降低,不符合氧化还原反应的要求,所以C不合理;
D.铁的化合价升高,硫的化合价部分降低,所以D合理。
所以选C。
(2)“摩尔盐”中含有NH4+,可以加入强碱溶液,加热,用湿润的红色石蕊试纸检验逸出的氨气。加入强碱溶液后,Fe2+可以和OH-生成Fe(OH)2白色沉淀,白色沉淀会迅速变成灰绿色,最后变成红褐色的Fe(OH)3,可以据此检验Fe2+。SO42-可以用稀盐酸和Ba2+检验,产生不溶于盐酸的白色沉淀BaSO4,所以选择既可以提供OH-又能提供Ba2+的Ba(OH)2溶液;若“摩尔盐”因氧化而变质,则会存在Fe3+,可以用KSCN溶液检验。故答案为Ba(OH)2,硫氰化钾溶液,溶液不变红色。
(3)①“摩尔盐”加热分解完全后打开K,再通入N2,目的是使分解产生的气体在B、C中被吸收充分。
②实验中观察到C中产生白色沉淀,原因是SO2通入C中,被H2O2氧化为SO42-,SO42-和Ba2+生成了BaSO4。则C中发生反应的离子方程式为SO2+H2O2+Ba2+=BaSO4↓+2H+。
③A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,若产物中有FeO,则溶于稀硫酸后生成的Fe2+能使KMnO4稀溶液褪色,KMnO4稀溶液不褪色证明产物不含FeO。
(4)实验中观察到A中固体逐渐变为红棕色,所以“摩尔盐”分解产生了Fe2O3,B中产生白色沉淀,可能是生成了SO3,进入水溶液中后和水反应生成了H2SO4,H2SO4和BaCl2反应生成了BaSO4,也可能是氨气和SO2一起进入B中,氨和SO2生成的(NH4)2SO3和BaCl2反应生成了BaSO3。C中产生白色沉淀,是SO2通入C中,被H2O2氧化为SO42-,SO42-和Ba2+生成了BaSO4。所以一定有SO2和Fe2O3生成。则上述猜想中一定正确的是A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】关于如图所示装置的叙述,正确的是
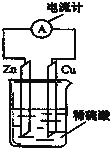
A.该装置构成原电池,锌易失电子作负极、Cu 作正极,负极上电极反应式为 Zn-2e-=Zn2+,所以锌的质量逐渐减少
B.电流从负极锌沿导线流向正极铜
C.该装置是将电能转化为化学能的装置,为原电池
D.氢离子在锌片上被还原,所以锌片上有气泡生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如下:

有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10 mL环己醇的A中,在55 ~ 60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为____________________________。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的![]() ,反应剧烈将导致体系温度迅速上升,副反应增多。
,反应剧烈将导致体系温度迅速上升,副反应增多。
①滴加酸性Na2Cr2O7溶液的操作为____________________________________________;
②蒸馏不能分离环己酮和水的原因是__________________________________________。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加人无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是________________________________________________;
②B中水层用乙醚萃取的目的是______________________________________________;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有__________,操作d中,加入NaC1固体的作用是_____________________________。
(4)恢复至室温时,分离得到纯产品体积为6 mL,则环已酮的产率为____________。(计算结果精确到0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇酸树脂是一种成膜性好的树脂,下面是一种醇酸树脂的合成线路:
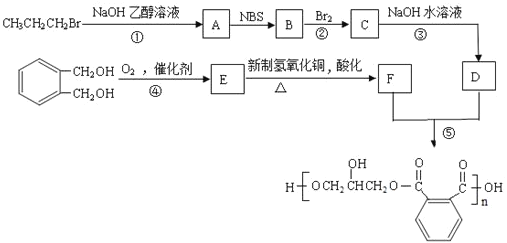
已知:RCH2CH=CH2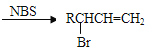
(1)写出B的结构简式是___。
(2)反应①~⑤中属于取代反应的是___(填序号)。
(3)写出由C→D的化学方程式___。
(4)写出由E与新制氢氧化铜反应的化学方程式___,现象___。
(5)下列说法正确的是___(填字母)。
a.1molE与足量的银氨溶液反应能生成2molAg
b.1molF能与足量的NaHCO3反应产生1molCO2
c.丁烷、1﹣丙醇和D中沸点最高的为D
(6)写出符合下列条件的与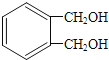 互为同分异构体的结构简式___。
互为同分异构体的结构简式___。
a.能与浓溴水反应生成白色沉淀
b.苯环上一氯代物有两种
c.能发生消去反应
(7)反应⑤的化学方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会生活密切相关,下列说法正确的是( )
A.军舰船底镶嵌锌块作正极,以防船体被腐蚀
B.汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
C.金属冶炼过程是金属离子得电子变成金属单质的氧化过程
D.PM2.5颗粒![]() 微粒直径约为2.5×106m)分散在空气中形成气溶胶
微粒直径约为2.5×106m)分散在空气中形成气溶胶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
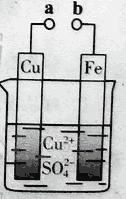
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 A、B、C、D、E 的原子序数依次增大。常温下,A、C 组成的化合物是常见液体,B 原子最外层电子数等于次外层电子数的 2 倍,D 与 C 同主族。回答下列问题:
(1) A 的单质的电子式为 ______ ;B 在元素周期表中的位置为第____周期第_____ 族。
(2) B、C 中,原子半径大的是______(填元素符号);D、E 的简单氢化物中,稳定性较强的是______(填化学式)。
(3) A、C 组成的原子个数比为 1:1 的化合物常用于制备 C 的单质,反应的化学方程式为 _______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素。碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如下:
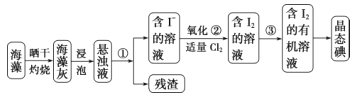
(1) 指出从海藻中提取 I2 的实验操作名称:① _______ ,③_______;写出②的离子方程式:______ 。
(2) 提取碘的过程中,可供选择的有机溶剂是________。
A 酒精 B 四氯化碳 C 醋酸 D 甘油
(3) 为使海藻中 I-转化为碘的有机溶液,实验室里有坩埚、烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器,还缺少的仪器是 _____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是白色砂状或淡黄色粉末状固体,易溶于水、不溶于醇,该物质具有强还原性,在空气中易被氧化为NaHSO4,75℃以上会分解产生SO2。是重要的有机合成原料和漂白剂。
制取Na2S2O4常用甲酸钠法:控制温度60~70℃,在甲酸钠(HCOONa)的甲醇溶液中,边搅拌边滴加Na2CO3甲醇溶液,同时通入SO2,即可生成Na2S2O4。反应原理如下:2HCOONa+4SO2+Na2CO3=2Na2S2O4+H2O+3CO2
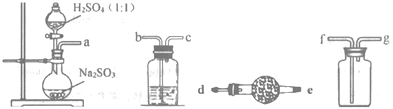
(1)如图,要制备并收集干燥纯净的SO2气体,接口连接的顺序为:a接__,__接__,__接__。制备SO2的化学方程式为___。
(2)实验室用图装置制备Na2S2O4。
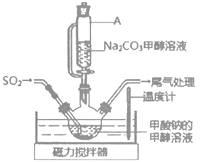
①Na2S2O4中硫元素的化合价为___。
②仪器A的名称是___。
③水浴加热前要通一段时间N2,目的是___。
④为得到较纯的连二亚硫酸钠,需要对在过滤时得到的连二亚硫酸纳进行洗涤,洗涤的方法是___。
⑤若实验中所用Na2SO3的质量为6.3g,充分反应后,最终得到mg纯净的连二亚硫酸钠,则连二亚硫酸钠的产率为___(用含m的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com