
【题目】短周期主族元素 A、B、C、D、E 的原子序数依次增大。常温下,A、C 组成的化合物是常见液体,B 原子最外层电子数等于次外层电子数的 2 倍,D 与 C 同主族。回答下列问题:
(1) A 的单质的电子式为 ______ ;B 在元素周期表中的位置为第____周期第_____ 族。
(2) B、C 中,原子半径大的是______(填元素符号);D、E 的简单氢化物中,稳定性较强的是______(填化学式)。
(3) A、C 组成的原子个数比为 1:1 的化合物常用于制备 C 的单质,反应的化学方程式为 _______ 。
【答案】H∶H 二 ⅣA C HCl 2H2O2 ![]() 2 2H2O2+O2↑
2 2H2O2+O2↑
【解析】
常见的无色液体是水,因此,A是氢元素,C是氧元素。B应该位于第二周期,B原子最外层电子数等于次外层电子数2倍,则B是碳元素。D与氧元素同主族,则D是硫元素,E只能是氯元素。
(1)H2的电子式为H∶H;碳原子的电子层数为2,最外层电子数为4,它位于第二周期、ⅣA族,
故答案为:H∶H ;二 ;ⅣA;
(2)同一周期从左到右,元素的原子半径依次减小,所以,铍与氧中,原子半径较大的是C;同一周期从左到右,元素的非金属性依次增强,所以,非金属性:Cl>S,两种元素的简单氢化物中稳定性较强的是HCl,
故答案为:C ; HCl;
(3)氢元素与氧元素可组成两种化合物,其中原子个数比为1:1的化合物是H2O2,实验室常用过氧化氢的分子反应制备氧气,反应的化学方程式为:2H2O2 ![]() 2 2H2O2+O2↑,
2 2H2O2+O2↑,
故答案为:2H2O2 ![]() 2 2H2O2+O2↑。
2 2H2O2+O2↑。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】尼泊金甲酯用作化妆品防腐剂,其结构为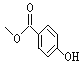 。下列有关说法正确的是( )
。下列有关说法正确的是( )
A.1mol尼泊金甲酯完全燃烧消耗7molO2
B.该化合物能与溴水反应,也能与NaHCO3反应
C.该化合物的同分异构体可能含有羧基
D.1mol该化合物最多可与4molH2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. “84”消毒液中:SiO32-、CO32-、Na+、K+
B. ![]() 的溶液中NH4+、Ca2+、C1-、NO3-
的溶液中NH4+、Ca2+、C1-、NO3-
C. 0.1mol/LNaA1O2溶液中:HCO3-、NH4+、SO32-、Fe3+
D. pH=1的溶液中:Na+、K+、Cl-、S2O32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:

I.图一中A为教材制备乙酸乙酯的实验装置,甲同学认为图一中B装置比A要好,则冷却水应从______口进入;乙同学认为图一中C装置效果更好,理由是_______。
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)26H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)[提出猜想]小组同学认为分解产物可能有以下几种情况:
A.Fe2O3、SO2、NH3、H2O B.FeO、SO3、NH3、H2O
C.FeO、SO2、NH3、H2O D.Fe2O3、SO3、SO2、NH3、H2O
根据所学知识,可确定_________不成立(填序号)
(2)[药品验纯]甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和_________溶液检验出“摩尔盐”中的三种离子;取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加_______(填试剂名称和实验现象),则“摩尔盐”未因氧化而变质。
(3)[实验探究]为检验分解产物,甲同学设计了如下实验装置。
①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是________。
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀.C中发生反应的离子方程式为________。
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含______。
(4)[实验结论与反思]通过实验现象和认真反思,上述猜想中一定正确的是______。(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将锌片和铜片按不同方式插入稀硫酸中,下列说法正确的是( )
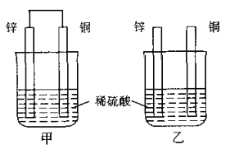
A. 甲中电子经导线从铜片流向锌片
B. 两烧杯中锌片上均发生还原反应
C. 两烧杯中铜片表面均无气泡产生
D. 一段时间后,两烧杯中溶液的c(H+)均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图是一个化学过程的示意图。
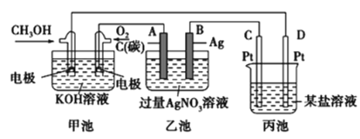
①乙池中总反应的离子方程式____________。
②电解一段时间后,向乙池的溶液中加入________________可恢复为原溶液。
③当乙池中B(Ag)极的质量增加5.40g,此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是________。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
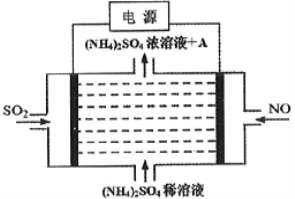
(2)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:

①写出负极的电极反应式:___________。
②图中X溶液是________。
③利用图中设计的原电池为电源可将雾霾中的NO、SO2电解分别转化为NH4+和SO42-,如图所示,则物质A的化学式为_____________,阴极的电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q核外最外层电子数与Y核外电子总数相同,X的原子半径是元素周期表中最小的。下列叙述正确的是
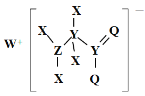
A.Z的最高价氧化物对应的水化物是一元强酸
B.WX的水溶液呈中性
C.元素非金属性的顺序为Y>Z>Q
D.该化合物中与Y单键相连的Q不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、D、E、W是中学常见的四种元素,原子序数依次增大,A的原子最外层电子数是次外层的2倍,D的氧化物属于两性氧化物,D、E位于同周期,A、D、E的原子最外层电子数之和为14,W是人体必需的微量元素,缺乏W会导致贫血症状。
(1)E在元素周期表中的位置是____________。A与E组成的化合物是常用的溶剂,写出其电子式__________________
(2)下列事实能用元素周期表相应规律解释的是(填字母序号)____________。
a.D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
b.E的气态氢化物的稳定性小于HF
c.A的单质能与二氧化硅高温下制得粗品硅单质
(3)WE3的溶液可用于刻蚀铜制的印刷电路板,反应的离子方程式为______。
(4)W的单质可用于处理酸性废水中的NO3-,使其转换为NH4+,同时生成有磁性的W的氧化物X,再进行后续处理,上述反应的离子方程式为______________。上述W的氧化物X能与D的单质反应,写出该反应的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)= 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)= CO2(g) ΔH2=-393.5 kJ/mol
(3)H2(g)+![]() O2(g)= H2O(l) ΔH3=-285.8 kJ/mol
O2(g)= H2O(l) ΔH3=-285.8 kJ/mol
则反应2C(s)+2H2(g)+O2(g)= CH3COOH(l)的焓变为( ).
A.-488.3 kJ/molB.-244.15 kJ/molC.488.3 kJ/molD.244.15 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com