
【题目】A、D、E、W是中学常见的四种元素,原子序数依次增大,A的原子最外层电子数是次外层的2倍,D的氧化物属于两性氧化物,D、E位于同周期,A、D、E的原子最外层电子数之和为14,W是人体必需的微量元素,缺乏W会导致贫血症状。
(1)E在元素周期表中的位置是____________。A与E组成的化合物是常用的溶剂,写出其电子式__________________
(2)下列事实能用元素周期表相应规律解释的是(填字母序号)____________。
a.D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
b.E的气态氢化物的稳定性小于HF
c.A的单质能与二氧化硅高温下制得粗品硅单质
(3)WE3的溶液可用于刻蚀铜制的印刷电路板,反应的离子方程式为______。
(4)W的单质可用于处理酸性废水中的NO3-,使其转换为NH4+,同时生成有磁性的W的氧化物X,再进行后续处理,上述反应的离子方程式为______________。上述W的氧化物X能与D的单质反应,写出该反应的化学方程式为____________________。
【答案】第三周期ⅦA族 ![]() ab
ab ![]()
![]()

【解析】
A、D、E、W是中学常见的四种元素,原子序数依次增大,A的原子最外层电子数是次外层的2倍,A为![]() 元素;D的氧化物属于两性氧化物,D为
元素;D的氧化物属于两性氧化物,D为![]() ;D、E位于同周期,A、D、E的原子最外层电子数之和为14,14-4-3=7,则E为
;D、E位于同周期,A、D、E的原子最外层电子数之和为14,14-4-3=7,则E为![]() ;W是人体必需的微量元素,缺乏W会导致贫血症状,W为
;W是人体必需的微量元素,缺乏W会导致贫血症状,W为![]() ;
;
(1)E为![]() ,在元素周期表中的位置是第三周期ⅦA族,A与E组成的化合物是常用的溶剂,即
,在元素周期表中的位置是第三周期ⅦA族,A与E组成的化合物是常用的溶剂,即![]() ,电子式为
,电子式为![]() ,
,
故答案为:第三周期ⅦA族;![]() ;
;
(2)a.同周期元素金属性依次减弱,铝在镁的右边,所以金属性弱于镁,所以D的最高价氧化物对应水化物![]() 的碱性弱于
的碱性弱于![]() ,故a正确;
,故a正确;
b.同主族元素非金属性从上到下依次减弱,所以![]() 的非金属性强于
的非金属性强于![]() ,则氢化物稳定性
,则氢化物稳定性![]() 小于
小于![]() ,故b正确;
,故b正确;
c.碳单质和二氧化硅制取粗硅:![]() ,该反应不能证明碳的还原性比硅强,不能用元素周期表解释,故c错误;
,该反应不能证明碳的还原性比硅强,不能用元素周期表解释,故c错误;
故答案为:ab;
(3)![]() 溶液腐蚀通电路板,离子方程式为:
溶液腐蚀通电路板,离子方程式为:![]() ,
,
故答案为:![]() ;
;
(4)具有磁性的铁的氧化物为![]() ,酸性环境下,硝酸根和铁发生反应,
,酸性环境下,硝酸根和铁发生反应,![]() 被还原为
被还原为![]() ,铁被氧化为
,铁被氧化为![]() ,反应的方程式:
,反应的方程式:![]() ,
,![]() 和铝发生铝热反应生成铁和氧化铝,方程式:
和铝发生铝热反应生成铁和氧化铝,方程式: ;
;
故答案为:![]() ;
; 。
。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如下:

有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10 mL环己醇的A中,在55 ~ 60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为____________________________。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的![]() ,反应剧烈将导致体系温度迅速上升,副反应增多。
,反应剧烈将导致体系温度迅速上升,副反应增多。
①滴加酸性Na2Cr2O7溶液的操作为____________________________________________;
②蒸馏不能分离环己酮和水的原因是__________________________________________。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加人无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是________________________________________________;
②B中水层用乙醚萃取的目的是______________________________________________;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有__________,操作d中,加入NaC1固体的作用是_____________________________。
(4)恢复至室温时,分离得到纯产品体积为6 mL,则环已酮的产率为____________。(计算结果精确到0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 A、B、C、D、E 的原子序数依次增大。常温下,A、C 组成的化合物是常见液体,B 原子最外层电子数等于次外层电子数的 2 倍,D 与 C 同主族。回答下列问题:
(1) A 的单质的电子式为 ______ ;B 在元素周期表中的位置为第____周期第_____ 族。
(2) B、C 中,原子半径大的是______(填元素符号);D、E 的简单氢化物中,稳定性较强的是______(填化学式)。
(3) A、C 组成的原子个数比为 1:1 的化合物常用于制备 C 的单质,反应的化学方程式为 _______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素。碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如下:
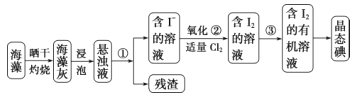
(1) 指出从海藻中提取 I2 的实验操作名称:① _______ ,③_______;写出②的离子方程式:______ 。
(2) 提取碘的过程中,可供选择的有机溶剂是________。
A 酒精 B 四氯化碳 C 醋酸 D 甘油
(3) 为使海藻中 I-转化为碘的有机溶液,实验室里有坩埚、烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器,还缺少的仪器是 _____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:
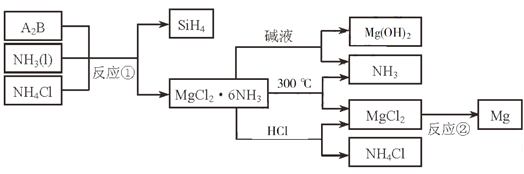
(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________,Mg在元素周期表中的位置:_____________________,Mg(OH)2的电子式:____________________。
(2)A2B的化学式为_______________。反应②的必备条件是_______________。上图中可以循环使用的物质有_______________。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________(写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
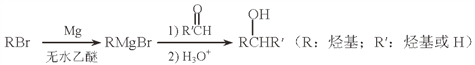
依据上述信息,写出制备![]() 所需醛的可能结构简式:_______________。
所需醛的可能结构简式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活、环境等密切相关,下列说法正确的是![]()
A.用加酶洗衣粉洗衣服时水的温度越高越好
B.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关
C.小苏打是制作馒头的膨松剂,苏打是治疗胃酸过多的抗酸剂
D.乙醇、过氧化氢、次氯酸钠等消毒液的消毒原理都是利用其强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置的说法中正确的是
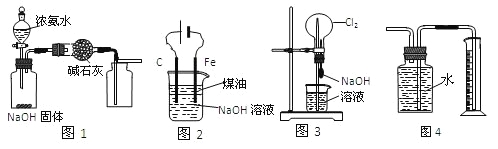
A. 用图1装置制取干燥纯净的NH3
B. 用图2装置制备Fe(OH)2并能较长时间观察其颜色
C. 用图3装置可以完成“喷泉”实验
D. 用图4装置测量Cu与浓硝酸反应产生气体的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是白色砂状或淡黄色粉末状固体,易溶于水、不溶于醇,该物质具有强还原性,在空气中易被氧化为NaHSO4,75℃以上会分解产生SO2。是重要的有机合成原料和漂白剂。
制取Na2S2O4常用甲酸钠法:控制温度60~70℃,在甲酸钠(HCOONa)的甲醇溶液中,边搅拌边滴加Na2CO3甲醇溶液,同时通入SO2,即可生成Na2S2O4。反应原理如下:2HCOONa+4SO2+Na2CO3=2Na2S2O4+H2O+3CO2
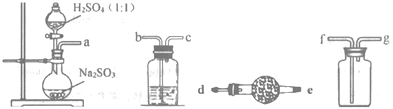
(1)如图,要制备并收集干燥纯净的SO2气体,接口连接的顺序为:a接__,__接__,__接__。制备SO2的化学方程式为___。
(2)实验室用图装置制备Na2S2O4。
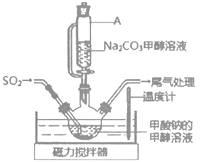
①Na2S2O4中硫元素的化合价为___。
②仪器A的名称是___。
③水浴加热前要通一段时间N2,目的是___。
④为得到较纯的连二亚硫酸钠,需要对在过滤时得到的连二亚硫酸纳进行洗涤,洗涤的方法是___。
⑤若实验中所用Na2SO3的质量为6.3g,充分反应后,最终得到mg纯净的连二亚硫酸钠,则连二亚硫酸钠的产率为___(用含m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.草酸与高锰酸钾在酸性条件下能够发生如反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,用 4mL 0.001mol/L KMnO4 溶液与2mL 0.01mol/L H2C2O4 溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
Ⅰ | 2mL | 20 | |
Ⅱ | 2mL | 20 | 10 滴饱和 MnSO4 溶液 |
Ⅲ | 2mL | 30 | |
Ⅳ | 1mL | 20 | 1mL 蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为_____
(2)如果研究催化剂对化学反应速率的影响,使用实验_________和_____(用Ⅰ~Ⅳ表示,下同); 如果研究温度对化学反应速率的影响,使用实验_____和_________.
(3)对比实验Ⅰ和Ⅳ,可以研究_____对化学反应速率的影响,实验Ⅳ中加入 1mL蒸馏水的目的是_______
II、利用如图装置采用适当试剂可完成某探究实验,并得出相应实验结论.请根据相关信息回答:

(1)为了证明元素的非金属性强弱是 S>C>Si.你认为各物质应该是: 甲为______;乙为______;丙为______.(已知乙中有气泡产生,丙中 有白色沉淀)
(2)如果甲为水,乙为 Na2O2 粉末,丙为 H2S 的饱和水溶液.实验中观察到丙中生成淡黄色沉淀。说明元素O、S得电子能力强弱为 ______。
(3)将该装置连接好后,在加入药品开始实验前还需进行气密性检查,请你简述该操作_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com