【答案】
分析:(1)常温下,纯水中c(H+)=10
-7mol?L
-1,加入某物质后,溶液中c(H+)=10
-9mol?L
-1,说明溶液呈碱性,则加入的物质的水溶液呈碱性;
(2)氯水中存在的平衡是Cl
2+H
2O?H
++Cl
-+HClO、HClO?H
++ClO
-,要使c(HC10)增大,加入某些物质使Cl
2+H
2O?H
++Cl
-+HClO的平衡向正反应方向移动或使HClO?H
++ClO
-的平衡向逆反应方向移动;
(3)一水合氨为弱电解质,不能完全电离,pH相同时,氨水浓度最大;
(4)①根据反应H
2B(少量)+2A
-=B
2-+2HA,可知,HA酸性小于H
2B,HA酸性最弱,酸性越弱,对应的酸根离子得H
+能力越强;
②铜离子和硫化氢只所以能生成硫化铜沉淀,硫化铜既难溶于水又难溶于酸;
(5)H
2A=H
++HA
-,HA
-?H
++A
2-可知,第一步完全电离,第二步不完全电离,结合0.lmol?L
-1NaHA溶液的pH=2确定0.1mol?L
-1的H
2A溶液中氢离子浓度的大小范围,0.lmol?L
-1NaHA溶液的pH=2,则HA
-的电离大于其水解,再结合水解、电离的相关知识来解答;
(6)根据混合溶液中氯离子的浓度结合溶度积常数计算银离子浓度,根据氢离子浓度计算溶液的pH.
解答:解:(1)常温下,纯水中c(H+)=10
-7mol?L
-1,加入某物质后,溶液中c(H+)=10
-9mol?L
-1,说明溶液呈碱性,则加入的物质是碱或强碱弱酸盐,故选CD;
(2)氯水中存在的平衡是Cl
2+H
2O?H
++Cl
-+HClO、HClO?H
++ClO
-,要使c(HC10)增大,加入某些物质使Cl
2+H
2O?H
++Cl
-+HClO的平衡向正反应方向移动或使HClO?H
++ClO
-的平衡向逆反应方向移动,所以可以通入氯气或加入碳酸盐或加入次氯酸盐,故答案为:再通入氯气、加入碳酸盐、加入次氯酸钠;
(3)一水合氨为弱电解质,不能完全电离,与盐酸反应至中性时,氨水应稍过量,则b>a,c(OH
-)=1.0×10
-3mol.L
-l的氨水,一水合氨浓度远大于1.0×10
-3mol.L
-l的氨水,反应至中性时,a>c,氢氧化钡为强碱,与盐酸完全中和时,a=d,则b>a=d>c,故答案为:b>a=d>c;
(4)①据反应H
2B(少量)+2A
-=B
2-+2HA,可知,HA酸性小于H
2B,HA酸性最弱,酸性越弱,对应的酸根离子得H
+能力越强,没有HB
-生成,说明得电子能力A
-大于HB
-,则得电子能力顺序为A
->B
2->HB
-,故答案为:A
->B
2->HB
-;
②铜离子和硫化氢只所以能生成硫化铜沉淀,硫化铜既难溶于水又难溶于酸,所以硫化氢和硫酸铜能反应;
故答案为:铜离子和硫化氢只所以能生成硫化铜沉淀,是因为硫化铜既难溶于水又难溶于酸;
(5)H
2A=H
++HA
-,HA
-?H
++A
2-可知,第一步完全电离,第二步不完全电离,0.1mol?L
-1的H
2A溶液中H
2A第一步电离出氢离子浓度是0.1mol/L,0.1mol.L
-1的NaH A溶液其pH=2,说明HA
-电离比水解多出0.01mol/L,HA
-的电离较微弱,所以电离出氢离子浓度小于0.01mol/L,则0.1mol?L
-1的H
2A溶液中氢离子浓度的大小范围是0.1mol/L<c(H
+)<0.11mol/L,NaHA溶液中HA
-的电离大于其水解,则离子浓度的关系是c(Na
+)>c(HA
-)>c(H
+)>c(A
2-)>c(OH
-),
故答案为:0.1mol/L<c(H
+)<0.11mol/L,c(Na
+)>c(HA
-)>c(H
+)>c(A
2-)>c(OH
-);
(6)盐酸和硝酸银反应的物质的量之比是1:1,n(AgNO
3)=0.05L×0.018mo1?L
-l=9×10
-4 mol,n(HCl)=0.05L×0.020mol?L
-1=1×10
-3 mol,n(AgNO
3)<n(HCl),所以盐酸剩余,混合溶液中C(Cl
-)=c(HCl)=
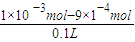
=10
-3 mol/L,c(Ag
+)=
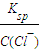
=
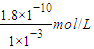
=1.8×10
-7 mol/L,c(H
+)=0.01mol/L,pH=2;
故答案为:1.8×10
-7mol/L;2.
点评:本题考查较为综合,题目难度较大,注意(4)①中比较阴离子结合H
+的难易的顺序,酸的酸性越弱,其阴离子越溶液结合氢离子,为易错点.

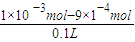 =10-3 mol/L,c(Ag+)=
=10-3 mol/L,c(Ag+)=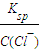 =
=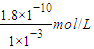 =1.8×10-7 mol/L,c(H+)=0.01mol/L,pH=2;
=1.8×10-7 mol/L,c(H+)=0.01mol/L,pH=2;

 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案 A、B、C、X是中学化学1中常见的4种物质,它们均由短周期元素组成,转化关系如图所示.请针对以下两种情况1回答下列问题:
A、B、C、X是中学化学1中常见的4种物质,它们均由短周期元素组成,转化关系如图所示.请针对以下两种情况1回答下列问题: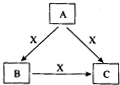 A、B、C、X是中学化学常见物质,转化关系如图所示.请针对以下不同情况回答问题:
A、B、C、X是中学化学常见物质,转化关系如图所示.请针对以下不同情况回答问题: A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下不同情况回答: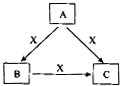 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下三种不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下三种不同情况回答:

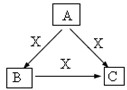 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图.请针对以下三种不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图.请针对以下三种不同情况回答: