
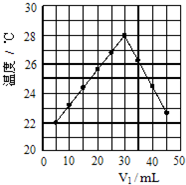
 将V1mL 1.0mol/L盐酸和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL 1.0mol/L盐酸和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A、由图可知进行该实验时环境温度约为22℃ |
| B、该实验表明1molH+(aq)和1molOH-(aq)的能量总和大于1mol H2O(l)的能量 |
| C、V1=30 mL时对应的中和热大于V1=10 mL时对应的中和热 |
| D、V1=10 mL时,混合后溶液的pH约为14 |
| 0.03L×1.0mol/L |
| 0.02L |
| 1.5mol/L×0.04L-1mol/L×0.01L |
| 0.05L |


科目:高中化学 来源: 题型:
| A、5:1 | B、3:1 |
| C、1:3 | D、1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
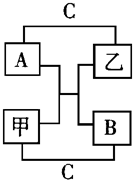 A、B、C是短周期里的3种元素的单质,甲、乙是常见的化合物,它们之间存在如图所示的转化关系:若A为有色气体,C 为无色气体,B为淡黄色固体,请回答:
A、B、C是短周期里的3种元素的单质,甲、乙是常见的化合物,它们之间存在如图所示的转化关系:若A为有色气体,C 为无色气体,B为淡黄色固体,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6A% | ||
B、
| ||
| C、10A% | ||
D、(100-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com