
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2.E的阳离子与A的阴离子核外电子层结构完全相同.
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2.E的阳离子与A的阴离子核外电子层结构完全相同.查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)有A、B、C、D、E五种短周期元素,已知相邻的A、 B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2。E的阳离子与A的阴离子核外电子层结构完全相同。回答下列问题:
(1)五种元素的名称:A______,B______, C______,D______,E______。
(2)B、C、D元素的原子半径由大到小的顺序为__________________________,
它们的最高价氧化物对应水化物的酸性强弱顺序为_________________________。
(3)写出C单质在足量A单质中燃烧后的产物与D单质同时通入水中的化学方程式 ____。
(4)A与E形成的化合物的化学式是 ____,它的性质决定了它在物质的分类中应属于 ____。
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量时,观察到的现象是 ____,有关反应的离子方程式为 ____。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省福州八县(市)一中高二下学期期中联考化学试卷 题型:填空题
(22分)已知X、Y、Z三种短周期主族元素在元素周期表中的位置关系如图所示。
| Z | |
| Y | X |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省苏北三市高三第二次调研测试化学试卷(解析版) 题型:选择题
已知在相同条件下酸性强弱顺序为:CH3COOH>H2CO3>HCN>HCO3—。下列表述不正确的是
A.25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中:c(Na+)=c(CN-),则a一定大于b
C.0.1 mol·L-1的Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3)
D.25℃时,pH=4.75,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液:c(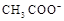 )+c(
)+c( )<c(CH3COOH)+c(H+)
)<c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源:2012届福建省福州八县(市高二下学期期中联考化学试卷 题型:填空题
(22分)已知X、Y、Z三种短周期主族元素在元素周期表中的位置关系如图所示。
|
Z |
|
|
Y |
X |
请回答:(1)三种元素中原子半径最大的是 (填X、Y或Z)
(2)若X的单质是黄绿色气体,则X和Y的最高价氧化物对应的水化物的酸性强弱顺序为 (用化学式表示),和X同主族元素氢化物中熔沸点最高的是 (用化学式表示),原因是 ;X单质溶于水生成物之一具有漂白性,写出该物质结构式 。
(3)若X的单质与强酸、强碱溶液反应均能放出氢气,则元素X在周期表中的位置 写出X单质和烧碱溶液反应的离子方程式
探究X和Y两种元素金属性强弱的实验方法是 。
(4)若Y的氧化物是制造光导纤维的材料,则Y元素的名称是 ,
工业上利用单质Z和Y的氧化物高温下反应,生成一种具有空间立体网状结构的化合物,另一种生成物是有毒气体,写出反应化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com