
已知在相同条件下酸性强弱顺序为:CH3COOH>H2CO3>HCN>HCO3—。下列表述不正确的是
A.25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中:c(Na+)=c(CN-),则a一定大于b
C.0.1 mol·L-1的Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3)
D.25℃时,pH=4.75,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液:c(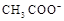 )+c(
)+c( )<c(CH3COOH)+c(H+)
)<c(CH3COOH)+c(H+)
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:

| O | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2001~2002学年度第二学期形成性练习 题型:043
![]() 溶液在碱性或中性环境中很稳定,在酸性条件下,
溶液在碱性或中性环境中很稳定,在酸性条件下,![]() 按下式分解,并处于下列平衡状态:
按下式分解,并处于下列平衡状态:![]() +
+![]()
![]()
![]() +S,冲洗摄影胶片的普通酸性定影药液成份如下:
+S,冲洗摄影胶片的普通酸性定影药液成份如下:
①![]() 250g②
250g②![]() 25g③
25g③![]() 20mL
20mL
④加水至1000mL.配制定影液必须严格按照上列药品顺序逐一溶解,若按①→③→②→④或③→①→②→④的顺序所配定影液是浑浊的,(已知在相同条件下,![]() 电离度大于
电离度大于![]() 的电离度)请回答:
的电离度)请回答:
(1)解释并用离子方程式表示浑浊的原因:
________________________________________________________
________________________________________________________
(2)用化学平衡移动的原理解释![]() 在酸性定影液中的作用
在酸性定影液中的作用
________________________________________________________
________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com