
| A、②③ | B、①③ | C、①②④ | D、①② |


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
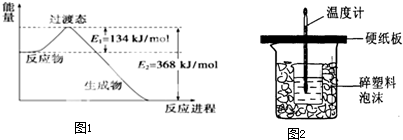
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电池工作时,电子由铝板沿导线流向铂网 |
| B、负极的电极反应式为O2+2H2O+4e-═4OH- |
| C、铂电极做成网状,可增大与氧气的接触面积 |
| D、该电池通常只需要更换铝板就可继续使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属氧化物都是碱性氧化物 |
| B、由同种元素组成的物质一定是单质 |
| C、盐电离出的离子不一定有金属离子 |
| D、非金属氧化物都是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、②④⑤ |
| C、②③ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3=Na++CO32- |
| B、Ba(OH)2=Ba2++OH2- |
| C、H2SO4=H2++SO42- |
| D、NaCl=Na++Cl- |
| E、NaCl=Na++Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com