
【题目】一定条件下,体积不变容器中,N2(g) + 3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,反应速率的变化如图所示,下列说法不正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,反应速率的变化如图所示,下列说法不正确的是( )

A. t1时刻增大c(N2)或c(H2)B. t2时刻加入催化剂
C. t3时刻降低温度D. t4时刻往容器中充入He,以增大体系压强
【答案】D
【解析】
由图象可知,t1时正反应速率突然增大,逆反应速率不变;t2时正、逆反应速率同等程度增大,t3时正、逆反应速率突然减小,t4时正、逆反应速率突然增大,结合影响化学反应速率和化学平衡的因素分析解答。
A.t1时正反应速率突然增大,逆反应速率不变,正反应速率大于逆反应速率,则平衡正向移动,应为增大反应物浓度,故A正确;
B.t2时正、逆反应速率同等程度增大,平衡不移动,则为使用了催化剂,故B正确;
C.t3时正、逆反应速率突然减小,正反应速率大于逆反应速率,则平衡正向移动,该反应为放热反应,则为降低温度,故C正确;
D.t4时正、逆反应速率突然增大,正反应速率大于逆反应速率,则平衡正向移动,则应为增大压强,但往容器中充入He,以增大体系压强,反应物和生成物浓度不变,平衡不移动,故D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】在25℃时,向20.00mL0.10mol/L一元弱碱MOH溶液中滴0.10mol/LHCl溶液,混合溶液的pH、pOH变化曲线如图所示。已知pOH=-lgc(OH-)。下列说法错误的是( )
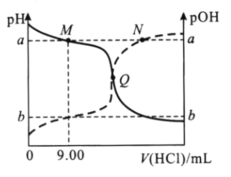
A.a+b=14
B.Q点消耗盐酸的体积小于20.00mL
C.M点和N点溶液中,![]() 相等
相等
D.当V(HCl)=10.00mL时,c(M+)-c(MOH)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚主要用于替代汽车燃油、制氢及用于燃料电池原料。 回答下列问题
⑴二甲醚在加热条件下能发生分解:(CH3)2O(g)→CH4(g)+H2(g)+CO(g),在某温度压强下测定其动力学数据如下:
t/s | 0 | 200 | 400 | 600 | 800 |
c[(CH3)2O]/mol·L-1 | 0.01000 | 0.00916 | 0.00839 | 0.00768 | 0.00702 |
0~800s 的二甲醚平均反应速率为__________________ 。
⑵一种“直接二甲醚燃料电池”结构如下图所示,电解质为强酸溶液。电池工作时,能量转化方式为______,负极的电极反应式为 ____。

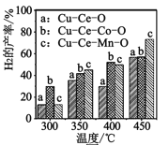
⑶二甲醚与水蒸气重整制 H2,相同投料比及流速时,单位时间内 H2 产率与催化剂及温度下关系如下图 所示,适宜的催化剂是______(选填 a、b、c)及适宜的温度是____ 。
⑷工业中用 CO 和 H2 为原料可制取二甲醚,在 250℃、5MPa 及催化剂作用下,在反应器中合成。
a:3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) K1
b:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) K2
c:CO(g)+2H2(g) CH3OH(g)
已知:投料比 n(H2)/n(CO2)与原料气转化率的关系如下图 所示。
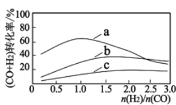
①最佳 n(H2)/n(CO)比为_________________ (填图中数字)。
②同一温度下,CO(g)+H2O(g) CO2(g)+H2(g)平衡常数为 K3,则 K3=__________用含 K1、K2 代数式表示)。
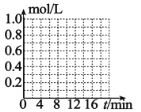
⑸已知反应 CO2(g)+3H2(g) CH3OH(g)+H2O(g)。一定条件下,向体积为 1L 的密闭容器中充入 1molCO2和 3molH2,测得 3min 时υ(H2)=0.5mol/L·min,10min 时达到平衡,平衡时,CO2 转化率为 75%,在下图中 画出 CO2 和 CH3OH(g)的浓度随时间变化曲线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关胶体的说法中,正确的是( )
A.根据是否具有丁达尔现象,将分散系分为溶液、浊液和胶体
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.将Fe(OH)3胶体和泥水分别过滤,发现均不能通过滤纸孔隙
D.用光束分别照射稀豆浆、FeCl3溶液都可以观察到丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】于固定体积的密闭容器中进行的气体反应A(g)+B(g) ![]() C(s)+2D(g),可以说明在恒温下已达到平衡状态的是
C(s)+2D(g),可以说明在恒温下已达到平衡状态的是
①反应容器中压强不随时间变化而变化 ②A气体和B气体的生成速率相等 ③混合气体的平均摩尔质量不随时间变化而变化 ④反应混合气体的密度不随时间变化而变化
A. ③④B. ②③C. ①③D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 对于N2(g) + 3H2(g) ![]() 2NH3(g)达到平衡,在温度不变、容积不变的密闭容器中充入N2,化学平衡常数变大
2NH3(g)达到平衡,在温度不变、容积不变的密闭容器中充入N2,化学平衡常数变大
B. 对某一可逆反应,升高温度则化学平衡常数一定变大
C. 平衡常数发生变化,化学平衡必定发生移动达到新的平衡
D. 改变条件,使反应物的平衡转化率都增大,该可逆反应的平衡常数一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分別为:①N2O+Fe+=N2+FeO (慢):②FeO++CO=CO2+Fe+ (快)。下列说法正确的是
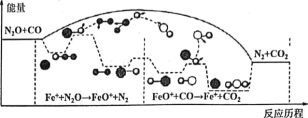
A. 反应①是氧化还原反应,反应②是非氧化还原反应
B. 两步反应均为放热反应,总反应的化学反应速率由反应②决定
C. Fe+使反应的活化能减小,FeO+是中间产物
D. 若转移lmol电子,则消耗II.2LN2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬、钼![]() 、钨
、钨![]() 都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。
都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。
![]() 铬元素的最高化合价为________;基态钼原子的核外电子排布类似于基态铬原子,其原子核外有________个未成对电子。
铬元素的最高化合价为________;基态钼原子的核外电子排布类似于基态铬原子,其原子核外有________个未成对电子。
![]() 钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
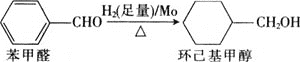
![]() 环己基甲醇分子中采取
环己基甲醇分子中采取![]() 杂化的原子是________
杂化的原子是________![]() 写元素符号
写元素符号![]() 。
。
![]() 环己基甲醇的沸点高于苯甲醛,其原因是________。
环己基甲醇的沸点高于苯甲醛,其原因是________。
![]() 铬离子
铬离子![]() 能形成多种配合物,例如
能形成多种配合物,例如![]() 。
。
![]() 已知配合物的中心粒子的配位数指配位原子总数。上述配合物中,
已知配合物的中心粒子的配位数指配位原子总数。上述配合物中,![]() 的配位数为________。
的配位数为________。
![]() 上述配合物中的非金属元素按电负性由小到大的顺序排列为________。
上述配合物中的非金属元素按电负性由小到大的顺序排列为________。
![]() 铬的一种氧化物的晶胞结构如图所示。
铬的一种氧化物的晶胞结构如图所示。
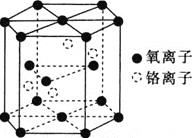
![]() 该氧化物的化学式为________。
该氧化物的化学式为________。
![]() 已知晶胞底面的边长为acm,晶胞的高为bcm,
已知晶胞底面的边长为acm,晶胞的高为bcm,![]() 代表阿伏加德罗常数的值,该铬的氧化物的摩尔质量为
代表阿伏加德罗常数的值,该铬的氧化物的摩尔质量为![]() 。该晶体的密度为________
。该晶体的密度为________![]() 用含a、b、
用含a、b、![]() 和M的代数式表示
和M的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)和次磷酸钠(NaH2PO2)都具有强还原性.都有着广泛的用途。
(1)已知:①N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-621.5 kJ●mol-1
②N2O4(l)-=N2(g)+2O2(g) △H2=+204.3 kJ●mol-1
则火箭燃料的燃烧反应为2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H=_____.
(2)已知反应N2H4(g)+ 2Cl2(g)![]() N2(g)+4HCl(g),T°C时,向V L恒容密闭容器中加入2 mol N2H4(g)和4 mol Cl2(g) ,测得Cl2和HCl的浓度随时间的关系如图所示。
N2(g)+4HCl(g),T°C时,向V L恒容密闭容器中加入2 mol N2H4(g)和4 mol Cl2(g) ,测得Cl2和HCl的浓度随时间的关系如图所示。
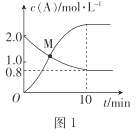
①0~ 10 min内,用N2(g)表示的平均反应速率v(N2)=_______。
②M点时,N2H4的转化率为______(精确到0.1)%。
③T °C时,达到平衡后再向该容器中加入1.2 mol N2H4(g)、0.4 mol Cl2(g)、0. 8 mol N2 (g)、1.2 mol HCl(g) ,此时平衡______(填“正向移动”“逆向移动”或“不移动”)。
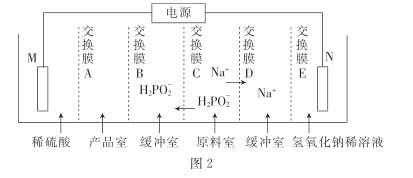
(3)①在惰性气体中,将黄磷(P4)与石灰乳和碳酸钠溶液一同加入高速乳化反应器中制得NaH2PO2,同时还产生磷化氢(PH3)气体,该反应的化学方程式为________________。
②次磷酸(H3PO2)是一元酸,常温下.1.0 mol●L-1的NaH2PO2溶液pH为8,则次磷酸的Ka=___________。
③用次磷酸钠通过电渗析法制备次磷酸.装置如图2所示。交换膜A属于____(填“阳离子”或“阴离子”)交换膜,电极N的电极反应式为______,当电路中流过3.8528×105库仑电量时.制得次磷酸的物质的量为_____ (一个电子的电量为 1.6×10- 19库仑,NA数值约为6. 02× 1023)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com