
����Ŀ��ij�����İ�����ˮ����Ҫ����![]() �����õ绯ѧ���������Դ�����
�����õ绯ѧ���������Դ�����
��1��ͼ1�ǵ绯ѧ��������ԭ��ʾ��ͼ��a�ĵ缫��Ӧʽ��_____________��
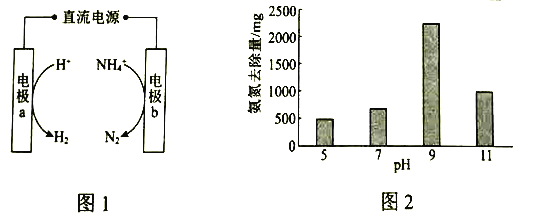
��2���о���ʾ��������������ʱ����ͬ![]() �°�����ȥ������ͼ2��ʾ����֪��
�°�����ȥ������ͼ2��ʾ����֪��![]() ��
��![]() ��ȣ��ڵ缫���������Ч�����á����ƽ���ƶ�ԭ����ͼ�����ݣ�����
��ȣ��ڵ缫���������Ч�����á����ƽ���ƶ�ԭ����ͼ�����ݣ�����![]() ��5��9ʱ����ȥ���������ԭ��______________��
��5��9ʱ����ȥ���������ԭ��______________��
��3���ڵ���ˮ�Ĺ����У�![]() �ᾭ����
�ᾭ����![]() ���Ĺ��̡�����������ͬ��
���Ĺ��̡�����������ͬ��![]() ��Ũ�Ȳ�ͬʱ����ˮ�а����ѳ�Ч�ʵ�ʵ�������£�
��Ũ�Ȳ�ͬʱ����ˮ�а����ѳ�Ч�ʵ�ʵ�������£�
| 400 | 100 |
���ʱ��/h | 0.5 | 0.5 |
�����ѳ�Ч��/�� | 2.40.8 |
������������ͬ���ʵ����![]() ��Ũ�ȣ��������������ˮ��
��Ũ�ȣ��������������ˮ��![]() ���ѳ�Ч�ʡ�
���ѳ�Ч�ʡ�
�û�ѧ�������ԭ��____________��![]() ��
��
��ͼ2�У�![]() ʱ����ˮ��
ʱ����ˮ��![]() ȥ�����½������ܵ�ԭ���ǣ�_______________��
ȥ�����½������ܵ�ԭ���ǣ�_______________��
���𰸡�![]() ��ˮ�д��ڣ�
��ˮ�д��ڣ�![]() ��
��![]() ����
����![]() ���ͣ�ƽ�������ƶ���
���ͣ�ƽ�������ƶ���![]() ���������ں������ڵ缫��������
���������ں������ڵ缫�������� ![]()
![]() �ϴ����ȷŵ磨��
�ϴ����ȷŵ磨��![]() ��
��![]() �������
�������![]() ��
��![]() �ݳ�����
�ݳ�����![]() ��
��![]() ������
������![]() ������������
������������![]() ������������
������������
��������
��1����װ��Ϊ���أ�a�缫��![]()
![]() �����ϼ۽��ͣ��õ�����Ϊ������
�����ϼ۽��ͣ��õ�����Ϊ������
��2����֪��![]() ��
��![]() ��ȣ��ڵ缫���������Ч�����á�
��ȣ��ڵ缫���������Ч�����á�![]() ����
����![]() ˮ�������
ˮ�������![]() Խ�࣬����ȥ��������
Խ�࣬����ȥ��������
��3������ˮ�Ĺ����У�![]() ��������ʧ���Ӳ���
��������ʧ���Ӳ���![]() ������
������![]() ����
����![]() ��
��
��span>4���ɴ�����Ũ�ȼ�С��![]() �ݳ��ȷ������֣�
�ݳ��ȷ������֣�
��1���ɷ�����֪������a�ĵ缫��Ӧʽ��![]() ��
��
��2����Ϸ�������ɿ�֪����ˮ�д��ڣ�![]() ����Һ
����Һ![]() ����
����![]() �ή�ͣ�ƽ�������ƶ���
�ή�ͣ�ƽ�������ƶ���![]() ����
����![]() ��
��![]() �ڵ缫���������Ч�����ã������ں������ڵ缫����������
�ڵ缫���������Ч�����ã������ں������ڵ缫����������
��3���ٵ���ˮ�Ĺ����У�![]() ��������ʧ���Ӳ���
��������ʧ���Ӳ���![]() ���缫��ӦʽΪ��
���缫��ӦʽΪ��![]() ��
��
�ڽ�Ϣ��ʣ�![]() ʱ����ˮ��
ʱ����ˮ��![]() ȥ�����½������ܵ�ԭ��������Ũ�ȼ�С���磺
ȥ�����½������ܵ�ԭ��������Ũ�ȼ�С���磺![]() �ϴ����ȷŵ磻
�ϴ����ȷŵ磻![]() ��
��![]() ������
������![]() ������������
������������![]() ������������
������������![]() �ݳ���
�ݳ���![]() ��
��![]() �������
�������![]() ��
��![]() �ݳ����ȡ�
�ݳ����ȡ�


 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д� �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ�����е����� CaCl2��MgCl2 �� Na2SO4,�������£�
![]()
�����й�˵���У�����ȷ����( )
A. ��ȥ Mg2+����Ҫ��Ӧ�� Mg2++ 2OH-=Mg(OH)2��
B. �Լ���һ������Na2CO3��Һ
C. ���� SO42-�Ƿ������ȡ������Һ����ϡ�����ữ���ټ� BaCl2 ��Һ
D. ��Һ��ϡ����ʱֻ������Ӧ��H+ +OH- =H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��K2FeO4��һ�ּ�������������������������ɱ���������ȹ�����һ�����ɫ��Чˮ���������ѳ�Ϊ������ɶ�ȱ������֮һ����ҵ�Ʊ�������ͼ��ʾ���ش��������⣺

��1����ʪ���Ʊ�Na2FeO4�����У���д���ȼҵ�������ö��Ե缫��ⱥ��NaCl��Һ�����ӷ���ʽ��___��NaClO��FeCl3�ڼ����������Ʊ�Na2FeO4�ķ�Ӧ�б�������ԭ���뱻��ԭ��ԭ�Ӹ�����Ϊ____����ѭ��ʹ�õ�����Ϊ___����дһ�֣���
��2����ⷨ�Ʊ�Na2FeO4�����У���������Ϊ��ƽ�壬��ʹ��ǰҪ������ɰ��ϸɰ��ĥ�⣬��Ŀ��Ϊ____���ѺϽ�������������������ҺΪNaOH��Һ����д�������缫��Ӧʽ��____��
��3���ɷ��Ʊ�Na2FeO4���������緢�ֵ��Ʊ����գ���д��NaClO���塢Fe(NO3)3��9H2O���塢NaOH�����ڸ������ڵ��������Ʊ�Na2FeO4�Ļ�ѧ����ʽ��_____��
��4����д����Na2FeO4�Ʊ�K2FeO4�Ļ�ѧ����ʽ��____����˵���÷�Ӧ�ܷ�����ԭ��____��
��5����K2FeO4�ᴿʱ��-5�汥��KOH��ԭ��____��K2FeO4����ɫˮ���������ܶ�ˮ��ɱ����������������ˮ�����ã���ԭ��Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.����£�11.2 L���飨CH4������ϩ��C2H4���Ļ�������к���ԭ�ӵ����ʵ���Ϊ2 mol
B.����£�0.1 mol CCl4��ռ�����Ϊ2.24 L
C.��������N2��CO���еķ�������ԼΪ6.02��1023��
D.���³�ѹ�£�1 mol�κ�������ռ�������Ϊ22.4 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ˮ��ԭ����ͼ��ʾ����֪��ˮ�к�![]() �����ӣ��缫Ϊ���Ե缫������������ȷ����
�����ӣ��缫Ϊ���Ե缫������������ȷ����
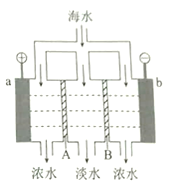
A. A�������ӽ���Ĥ
B. ��ˮ������������b�缫
C. a�ĵ缫��ӦΪ![]()
D. b��������ɫ���壬���ְ�ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʮ���ƣ�12CaO7Al2O3�������͵ij������Ϻͷ�����ϣ��ð���ʯ����Ҫ��CaCO3��MgCO3���ͷ�AlƬ�Ʊ�����ʮ���ƵĹ������£�
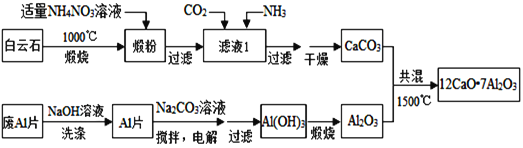
��1���ͷ���Ҫ��______��______��������NH4NO3��Һ��ȡ�ѷۺ�þ�����X�����ܡ��ù����в����ã�NH4��2SO4����NH4NO3��ԭ����_______________________________________________��
��2����Һ������������______���������ʳɷֵ�Ӱ�죩������Һ���н�ͨ��CO2��������______���Ӷ�����CaCO3���ʽ��ͣ�
��3����NaOH��Һ�ɳ�ȥ��AlƬ���������Ĥ����Ӧ�����ӷ���ʽΪ______________________��
��4������Ʊ�Al��OH��3ʱ���缫�ֱ�ΪAlƬ��ʯī������Ƭ�����Դ��____�������ʱ���������ķ�ӦΪ��______��
��5��һ�ֿɳ��������������أ���ŵ�ʱAlCl4����Al2Cl7������������Al�缫���ת�����������Ӳ�����缫��Ӧ���ŵ�ʱ����Al�ĵ缫��ӦʽΪ______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������Ƴ��Ľ��۲���ȷ���ǣ� ��
ѡ�� | ���� | ���� |
A | ��ˮ��Һ������״̬�¿��Ե���Ļ������Ϊ����� | ˮ�д��ڣ� |
B | �����ܸ������ӵķ��ӻ����ӳ�Ϊ�ᣬ�����ܽ������ӵķ��ӻ����ӳ�Ϊ�� |
|
C | ����Ϊ��Ԫ�����ˮ�еĵ��뷽ʽ�백���� | �����������γɵ���ʽ�εĻ�ѧʽΪ�� |
D | ������ѧ��Ӧʱ�����ܵ��ӶԵ�����Ϊ�ᣬ�ṩ���ӶԵ�����Ϊ�� |
|
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ϩ��![]() ���������Ʊ���ï����
���������Ʊ���ï����![]() ���ṹ��ʽΪ
���ṹ��ʽΪ![]() �������߹㷺���ں��졢����������ï���ĵ绯ѧ�Ʊ�ԭ����ͼ��ʾ������˵����ȷ���ǣ� ��
�������߹㷺���ں��졢����������ï���ĵ绯ѧ�Ʊ�ԭ����ͼ��ʾ������˵����ȷ���ǣ� ��
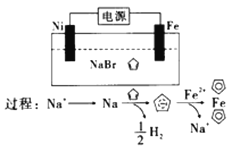
A. ![]() Ϊ���ص�����
Ϊ���ص�����
B. �������Һ������![]() ��ˮ��Һ
��ˮ��Һ
C. ���ص��ܷ�Ӧ����ʽΪ��![]()
D. �������Һ�У�����![]() ��
��![]() ��
��![]() �缫�ƶ�ʱ��ͬʱ��
�缫�ƶ�ʱ��ͬʱ��![]() �缫�ϲ�����
�缫�ϲ�����![]() ������
������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25����101KPa �£��� V L �Ȼ�����������ˮ�� V L ˮ��Һ�����ڸ���Һ��������ȷ����
A.��Һ�����ʵ���Ũ��Ϊ 1 mol/LB.��Һ�� c��H+��= ![]() mol/L
mol/L
C.��Һ��ˮ�������� H+��֮��Ϊ 1:1D.��Һ�����ʵ���Ũ����С��![]() mol/L
mol/L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com