
【题目】下列说法正确的是
A.标况下,11.2 L甲烷(CH4)和乙烯(C2H4)的混合气体中含氢原子的物质的量为2 mol
B.标况下,0.1 mol CCl4所占的体积为2.24 L
C.等质量的N2和CO含有的分子数均约为6.02×1023个
D.常温常压下,1 mol任何气体所占的体积均为22.4 L
科目:高中化学 来源: 题型:
【题目】25℃时,将SO2通入蒸馏水中模拟酸雨形成过程,实验数据如图。已知Ka1(H2SO3)=10-2,Ka2(H2SO3)=10-7。下列说法不正确的是

A. 300s未通O2时溶液中c(H2SO3)=10 -5.46mol·L-1
B. 400s时溶液中c(HSO3-)+c(SO32-)+c(SO42-)+c(H2SO3)≈10-3.73mol·L-1
C. 600s时,溶液中c(H+)约为c(SO42-)2倍
D. 由图推知,H2O2氧化性大于O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某课外小组制取乙炔并测定乙炔的某些性质的实验.

(1)写出实验室制取乙炔的化学方程式: ______.
(2)实验室制取乙炔时,分液漏斗中的液体 a通常是 ______.
(3)B溶液的作用是 ______.
(4)装置D中的现象是: ______.
(5)乙炔能否使溴的的四氯化碳溶液褪色?______(“能”或“不能”),若能写出完全反应原理_______________
(6)工业上常用乙炔、氯化氢等物质作原料来合成聚氯乙烯,请写出相关方程式 _______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2![]() 2O3。
2O3。
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为_______ g·mol-1(保留一位小数)。
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为________ L。
(3)在臭氧发生装置中装入氧气100 mL,经反应最后气体体积变为95 mL(体积均在标准状况下测定),则混合气体的密度是____________g·L-1(保留一位小数)
(4)实验室将氧气和臭氧的混合气体0.896 L(标准状况),通入盛有20.0 g铜粉的反应容器中,充分加热后,粉末的质量最终变为21.6 g。则原混合气中臭氧的体积分数______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在其他条件不变时,只改变某一条件,化学反应aA(g)+B(g)![]() cC(g)的平衡的变化图象如下(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率),据此分析下列说法正确的是
cC(g)的平衡的变化图象如下(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率),据此分析下列说法正确的是

A. 在图象反应Ⅰ中,说明正反应为吸热反应
B. 在图象反应Ⅰ中,若p1>p2,则此反应的ΔS>0
C. 在图象反应Ⅱ中,说明该正反应为吸热反应
D. 在图象反应Ⅲ中,若T1>T2,则该反应能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如下图所示。据图判断错误的是( )

A. a的数值一定大于9
B. Ⅱ为氨水稀释时溶液的pH变化曲线
C. 稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
D. 完全中和相同体积的两溶液时,消耗相同浓度的稀硫酸的体积:V(NaOH)<V(氨水)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:

(1)有机物M经过太阳光照可转化成N,转化过程如下:ΔH=+88.6 kJ·mol-1。则M、N相比,较稳定的是_______________。
(2)已知CH3OH(l)的燃烧热为238.6 kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-akJ·mol-1,则a____________238.6(填“>”、“<”或“=”)。
O2(g)=CO2(g)+2H2(g) ΔH=-akJ·mol-1,则a____________238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:____________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,反应的热化学方程式如下:4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1176 kJ·mol-1。则反应过程中,每转移1 mol e-放出的热量为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是药物合成中的一种重要中间体,下面是G的一种合成路线:
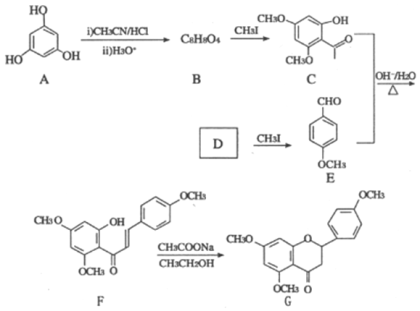
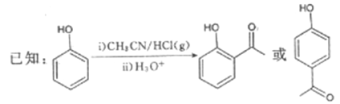
回答下列问题:
(1)B的结构简式为__________,其中所含官能团的名称为__________;B生成C的反应类型为__________。
(2)D的名称是__________。
(3)由C和E合成F的化学方程式为________________________________________。
(4)D的同分异构体中,能发生银镜反应且分子结构中含苯环的还有__________种,其中核磁共振氢谱上有6组峰,峰面积之比为1∶1∶1∶1∶1∶1的同分异构体的结构简式为______________________ (一种即可)。
(5)参照上述合成路线,以CH3CH2Cl为原料(其他试剂任选),设计制备巴豆醛(CH3CH=CH
CHO)的合成路线。_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com