
| A. | $\frac{{K}_{W}}{c({H}^{+})}$=0.1molgL-1的溶液:Na+、K+、SiO32-、NO3- | |
| B. | 加苯酚显紫色的溶液:K+、NH4+、Cl-、I- | |
| C. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| D. | 通足量SO2后的溶液:Na+、NH4+、ClO-、CH3COO- |
分析 A.$\frac{{K}_{W}}{c({H}^{+})}$=0.1molgL-1的溶液,显碱性;
B.加苯酚显紫色的溶液,含铁离子;
C.使紫色石蕊试液变红的溶液,显酸性;
D.通足量SO2后的溶液,显酸性和还原性.
解答 解:A.$\frac{{K}_{W}}{c({H}^{+})}$=0.1molgL-1的溶液,显碱性,该组离子之间不反应,可大量共存,故A正确;
B.加苯酚显紫色的溶液,含铁离子,与I-发生氧化还原反应,不能大量共存,故B错误;
C.使紫色石蕊试液变红的溶液,显酸性,Fe2+、H+、NO3-发生氧化还原反应,不能大量共存,故C错误;
D.通足量SO2后的溶液,显酸性和还原性,与ClO-发生氧化还原反应,且酸性溶液中不能大量存在CH3COO-,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:选择题
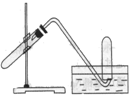
| A. | 加热NaHCO3制取和收集CO2 | |
| B. | 用铜和稀硝酸反应制取和收集NO | |
| C. | 用NH4Cl与浓NaOH溶液反应制取和收集NH3 | |
| D. | 用铜和浓硝酸反应制取和收集NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
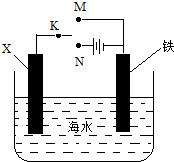
| A. | 若X为碳棒,为减缓铁的腐蚀,开关K应置于N处 | |
| B. | 若X为碳棒,开关K置于M处,会加快铁的腐蚀 | |
| C. | 若X为锌,开关K置于M处,就是牺牲阳极的阴极保护法 | |
| D. | 若X为锌,开关K置于N处,铁电极发生的反应为Fe-2e-═Fe${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室可用燃着的酒精灯取点燃另一只酒精灯 | |
| B. | 蒸馏实验时,在烧瓶内加几粒沸石以防止暴沸 | |
| C. | 化学品仓库保存的金属钠着火时可用水灭 | |
| D. | 盛放浓盐酸的试剂瓶上要贴上如图 的标志 的标志 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com