
【题目】甲醇(CH3OH)是一种重要的化工原料,既可用于化工生产,也可直接用做燃料。
(1)工业上可用CO2和H2反应制得甲醇。在2×105Pa、300℃的条件下,CO2和H2反应生成甲醇和水,当消耗2molCO2时放出98kJ的热量,该反应的热化学方程式为___________。
(2)甲醇也可由CO与H2反应制得。在一定温度下,初始容积相同的两个容器中(如图),发生反应: CO(g)+2H2(g)=CH30H(g)。

① 能表明甲和乙容器中反应一定达到平衡状态的是________(填字母代号)。
A.混合气体的密度保持不变 B.混合气体的总压强保持不变
C.CO的质量分数保持不变 D. CO 与H2的转化率之比为3 : 2
E.v(CO)=v(CH30H)
②两容器中反应达到平衡时,Co的转化率α甲______α乙(填“>”、“< ”或“=”)
(3)组成n(H2)/n(CO+CO2)=2.60时,体系中CO 的平衡转化率(α)动与温度和压强的关系如图所示。图中的压强由大到小依次为_______,其判断理由是______________。

(4)甲醇燃料电池(简称DMFC)可作为常规能源的替代品而备受关注。DMFC的工作原理如图所示:
① 加入a 物质的电极是电池的______(填“正”或“负”)极,其电极反应式为________.
② 常温下以该装置作电源,用惰性电极电解NaCl和CuSO4的混合溶液,当电路中通过0.4mol电子的电量时,两电极均得到0.14mol的气体。若电解后溶液体积为4OL,则电解后溶液的pH 为________。
【答案】 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49 kJ/mol C > P3>P2>P1 该反应为气体分子数减小的反应,在相同温度下,加压有利于提升CO的转化率 负 CH3OH+H2O
CH3OH(g)+H2O(g) ΔH=-49 kJ/mol C > P3>P2>P1 该反应为气体分子数减小的反应,在相同温度下,加压有利于提升CO的转化率 负 CH3OH+H2O![]() CO2+6H+ 11
CO2+6H+ 11
【解析】本题分析:本题主要考查化学平衡。
(1)在2×105Pa、300℃的条件下,CO2和H2反应生成甲醇和水,当消耗2molCO2时放出98kJ的热量,该反应的热化学方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49 kJ/mol。
CH3OH(g)+H2O(g) ΔH=-49 kJ/mol。
(2)① A.乙中混合气体的密度始终保持不变;B.甲中混合气体的总压强始终保持不变;C.CO的质量分数随着反应进行而变化,当保持不变时说明反应达到平衡状态;D. CO 与H2的转化率之比与平衡状态之间没有一定关系;E.都是正反应速率,不能说明反应达到平衡状态。故选C。
②该反应气体物质的量减少,甲相当于乙加压而成,加压平衡右移,两容器中反应达到平衡时,CO的转化率α甲>α乙。
(3) 图中的压强由大到小依次为P3>P2>P1,其判断理由是该反应为气体分子数减小的反应,在相同温度下,加压有利于提升CO的转化率。
(4)① 从电子移动方向可知,加入a 物质的电极是电池的负极,其电极反应式为CH3OH+H2O-6e-=CO2+6H+。
② 阴极首先生成铜,之后生成氢气和氢氧化钠 ,产生0.14mol氢气同时产生0.28molOH-。阳极产生氯气、氧气和硫酸,根据题意可得n(Cl2)+ n(O2)=0.14mol和2n(Cl2)+ 4n(O2)=0.40mol,解得 n(O2)=0.06mol,同时生成0.24molH+。电解后剩余0.04molOH-,溶液体积为4OL,则c(OH-)=1×10-3mol/L, c(H+)= 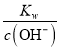 =
=![]() -mol/L =1×10-11mol/L,溶液的pH=11.
-mol/L =1×10-11mol/L,溶液的pH=11.


科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,11.2L氧气所含的O原子数为NA
B. 1mol/L的CaCl2溶液中含有的Cl﹣为2NA
C. 2.4g镁转化为Mg2+时失去的电子数目为0.2NA
D. 标准状况下,2g氦气所含原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所述物质一定不属于细胞膜组成成分的是
A. 含有C、H、O、N和P五种元素的脂质 B. 能与胰岛索特异性结合的物质
C. 转运氨基酸至一种无膜细胞器的物质 D. 能提高细胞与细胞之间黏着性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯璜化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 具有吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,反应的化学方程式为SO2(g)+Cl2(g) ![]() SO2Cl2(l)
SO2Cl2(l)
△H=-97.3kJ/mol。装置如图所示(夹持仪器已省略),请回答有关问题:

(1)仪器C的名称为___________________。
(2)仪器B的作用是_____________________。
(3)装置丙的作用为____________,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为___________________。
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_________(填序号)
①先通冷凝水,再通气 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是___________________。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、紫色石蕊溶液)__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
煤的综合利用是一个重要课题,下图是以煤为原料合成TNT和高聚物F的路线:

请回答下列问题:
(1)下列说法错误的是_______。(填字母代号)
A.煤中含有苯和甲苯,可用分馏的方法把它们分离出来
B.煤中含有的硫在燃烧时会以二氧化硫的形式排放,污染大气
C.煤是重要能源物质,也是冶金、化学工业的重要原料
D.煤化工是指以煤为原料,经化学加工使煤转化为气体、液体和固体燃料以及化学品的过程
(2)由![]() 生成烃A的反应类型为__________,TNT的核磁共振氢谱有__________个峰。
生成烃A的反应类型为__________,TNT的核磁共振氢谱有__________个峰。
(3)C的名称为_______。
(4)已知E为1,3-丁二烯,D与E以物质的量之比1:1发生聚合反应,且生成的高聚物F为顺式结构,请写出D与E反应的方程式:_____________________;反应③的反应条件为________________。
(5)研究发现,通过上述流程制备高聚物F的产率很低,进一步研究发现,在反应②中生成了大量副产物G,请写出G的结构简式:_______ 。则在G的同分异构体中,含有两个苯环和两个甲基的共有_____________种(不考虑立体异构)。
(6)请写出以CH3COOH、![]() 为原料合成化工产品
为原料合成化工产品 的路线流程图(无机试剂任选)(提示:卤代苯中苯环上的卤原子很难被取代)。_________
的路线流程图(无机试剂任选)(提示:卤代苯中苯环上的卤原子很难被取代)。_________
合成路线流程图示例如下:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟是自然界中广泛分布的元素之一。由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异。
Ⅰ.化学家研究发现,SbF5能将MnF4从离子[MnF6]2-的盐中反应得到,SbF5转化成稳定离子[SbF6]-的盐。而MnF4很不稳定,受热易分解为MnF3和F2。根据以上研究写出以K2MnF6和SbF5为原料,在 423 K 的温度下制备F2的化学方程式:_________________________。

现代工业以电解熔融的氟氢化钾(KHF2)和氟化氢(HF)混合物制备氟单质,电解制氟装置如图所示。
已知KHF2是一种酸式盐,写出阴极上发生的电极反应式________________________。电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是___________。
Ⅱ.①卤化氢的熔沸点随相对分子质量增加而升高,而HF熔沸点高于HCl的原因是________________________。HF的水溶液是氢氟酸,能用于蚀刻玻璃,其化学反应方程式为:________________________
②已知25 ℃时,氢氟酸(HF)的电离平衡常数Ka=3.6×10-4。
某pH=2的氢氟酸溶液,由水电离出的c(H+)=___________mol/L;若将0.01 mol/L HF溶液与pH=12的NaOH溶液等体积混合,则溶液中离子浓度大小关系为:________________________。
③又已知25 ℃时,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol/L HF溶液中加入 1 L 0.2 mol/L CaCl2 溶液,通过列式计算说明是否有沉淀产生:______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是①加快化石燃料的开采与使用;②研发易降解的生物农药;③应用高效洁净的能源转换技术;④田间焚烧秸秆;⑤推广使用节能环保材料。
A. ①③⑤ B. ②③⑤ C. ①②④ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞中化学元素的叙述,正确的是
A. 细胞中一种元素的作用能被其他元素替代
B. 细胞中的脱氧核苷酸和脂肪酸都不含有氮元素
C. 主动运输机制有助于维持细胞内元素组成的相对稳定
D. 细胞中的微量元素因含量极少而不如大量元素重要
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列事实的解释错误的是
A. 氨气极易溶于水,氨气能够做“喷泉”实验
B. 常温下,浓硝酸可用铝罐来贮存,说明常温下浓硝酸不与铝发生反应
C. 向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有脱水性
D. 氯气不能使干的有色布条褪色,能使湿润的有色布条褪色,说明次氯酸具有漂白性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com