
| A、H2S溶液 |
| B、KI溶液 |
| C、NaOH溶液 |
| D、Na2S溶液 |


科目:高中化学 来源: 题型:
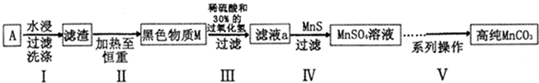
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 T/℃n/mol T/℃ | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
查看答案和解析>>
科目:高中化学 来源: 题型:
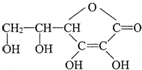 维生素C的结构简式如图,它的分子式是
维生素C的结构简式如图,它的分子式是查看答案和解析>>
科目:高中化学 来源: 题型:
 已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物在常温下均呈气态,在周期表中Z与W左右相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同.请回答下列问题:
已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物在常温下均呈气态,在周期表中Z与W左右相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
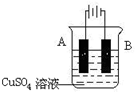
查看答案和解析>>
科目:高中化学 来源: 题型:
| 加A |
| 加热 |
| 加B |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |
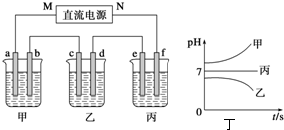
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com