
 已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物在常温下均呈气态,在周期表中Z与W左右相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同.请回答下列问题:
已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物在常温下均呈气态,在周期表中Z与W左右相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同.请回答下列问题:

 名题金卷系列答案
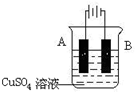
名题金卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
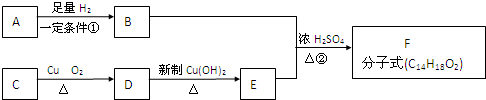
科目:高中化学 来源: 题型:
查看答案和解析>>
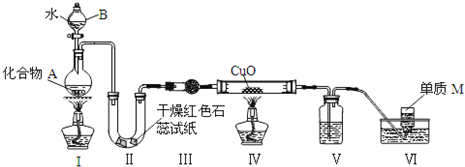
科目:高中化学 来源: 题型:
查看答案和解析>>
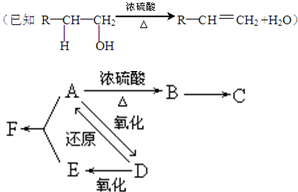
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2S溶液 |
| B、KI溶液 |
| C、NaOH溶液 |
| D、Na2S溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 答案 | 实验方法 |
| 检验Cl2 | A、焰色反应(透过蓝色的钴玻璃) | |
| 检验氨气 | B、先加盐酸,再加氯化钡溶液 | |
| 检验K+ | C、淀粉碘化钾试纸 | |
| 检验SO42- | D、湿润的红色石蕊试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、③④ |
| C、②③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com