


科目:高中化学 来源: 题型:
 已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物在常温下均呈气态,在周期表中Z与W左右相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同.请回答下列问题:
已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物在常温下均呈气态,在周期表中Z与W左右相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a、d、b、e、c |
| B、c、a、d、e、b |
| C、a、e、d、b、c |
| D、c、a、b、e、d |
查看答案和解析>>
科目:高中化学 来源: 题型:
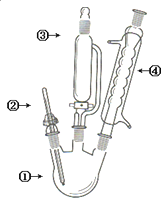 高中化学选修5《有机化学基础》第64页,有这样一个有机合成的装置图,有关下列仪器的名称和作用的叙述不正确的是( )
高中化学选修5《有机化学基础》第64页,有这样一个有机合成的装置图,有关下列仪器的名称和作用的叙述不正确的是( )| A、①三口烧瓶,用作反应器 |
| B、②为温度计,用于测量反应混合物的温度 |
| C、③为长颈漏斗,用于反应过程中添加反应液体 |
| D、④球形冷凝管,起冷凝、回流的作用,其冷水的进口在下方 |
查看答案和解析>>
科目:高中化学 来源: 题型:
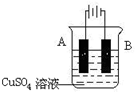
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |
查看答案和解析>>
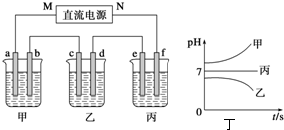
科目:高中化学 来源: 题型:
| A、阴极自始至终只有H2 |
| B、阳极先析出Cl2后析出O2 |
| C、电解最后阶段为电解水 |
| D、溶液pH不断增大,最后为7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SnO2?4H2O |
| B、Sn(NO3)4 |
| C、Sn(NO3)2 |
| D、Sn(NO3)2和Sn(NO3)4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
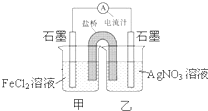 控制适合的条件,将反应Ag+Fe3+?Fe2++Ag+ 设计成如图所示的原电池.下列判断错误的是( )
控制适合的条件,将反应Ag+Fe3+?Fe2++Ag+ 设计成如图所示的原电池.下列判断错误的是( )| A、反应开始时,电子从甲中石墨经导线流向乙中石墨 |
| B、电流计指针为零时,上述反应的正反应速率等于逆反应速率 |
| C、电流计读数为零后,在甲中加入FeCl3固体,甲中石墨电极为负极 |
| D、电流计读数为零后,在甲中加入双氧水,甲中石墨电极反应式是Fe3++e-=Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com