
【题目】世界卫生组织(WHO)将ClO2列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。ClO2属于
A.酸B.碱C.氧化物D.盐
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂。工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是

A. b电极应该接电源的负极
B. 装置中所用离子交换膜为阴离子交换膜
C. 电路中每转移1mole-消耗SO2的体积为11.2L
D. a电极的电极反应式为:2HSO3-+2e-+2H+=S2O42-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 22.4L CO2与足量Na2O2完全反应,转移电子数为2NA
B. 6.4 g 由S2、S4、S8组成的混合物含硫原子数为0.2NA
C. 1mol/L的NaCl溶液中Cl—的数目为NA
D. 标况下,22.4L NO和11.2L O2,混合后气体分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,CO和CO2的混合气体共11.2L,质量为18 g
(1)求两种气体的物质的量之和是________。
(2)求混合气体的平均摩尔质量__________。
(3)求两种气体的体积分别是多少。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物F是一种重要的有机合成中间体,其合成路线如下图所示:

已知:①A的核磁共振氢谱图中显示两组峰
②F的结构简式为:
③通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
④
请回答下列问题:
(1)A的名称为______________(系统命名法);Z中所含官能团的名称是___________。
(2)反应Ⅰ的反应条件是__________;反应Ⅲ的反应类型为__________ 。
(3)E的结构简式为_______________________。
(4)写出反应Ⅴ的化学方程式____________________________________________。
(5)W是Z的同系物,相对分子质量比Z大14,则W的同分异构体中满足下列条件:
①能发生银镜反应,②苯环上有两个取代基,③不能水解,遇FeCl3溶液不显色的结构共有
_________种(不包括立体异构),核磁共振氢谱有四组峰的结构为____________。
(6)参照如下合成路线,设计以2—氯丙烷为起始原料合成丙醛的合成路线(无机试剂任选)_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
【实验Ⅰ】试剂:酸化的0.5 mol·L-1FeSO4溶液(pH = 0.2),5% H2O2溶液(pH = 5)
操作 | 现象 |
取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH=0.9 |
向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(1)H2O2的电子式是_______,上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是________。
(2)产生气泡的原因是____________________。
【实验Ⅱ】 试剂:未酸化的0.5 mol·L-1FeSO4溶液(pH = 3),5% H2O2溶液(pH = 5)
操作 | 现象 |
取2 mL5% H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊。测得反应后溶液pH=1.4 |
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加4mol·L-1盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有Fe2O3,经检验还含有SO42-。检验棕黄色沉淀中SO42-的方法是________。
(4)对于生成红褐色胶体的原因,提出两种假设:
i.H2O2溶液氧化Fe2+消耗H+
ii.Fe2+ 氧化的产物发生了水解
① 根据实验II记录否定假设i,理由是________。
② 实验验证假设ii:取Fe2(SO4)3溶液加热,溶液变为红褐色,pH下降,证明假设ii成立。
(5)将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是________。
【实验Ⅲ】
若用FeCl2溶液替代FeSO4溶液,其余操作与实验II相同,除了产生与II相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(6)产生刺激性气味气体的原因是________。
(7)由实验Ⅰ、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与________(至少写两点)有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,则X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为________________________。
(2)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2反应,其产物之一是Y的单质,Y的单质的电子式为________;Z分子的结构式________。
②A的化学式是________。
(3)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用某种粗盐进行提纯实验,步骤见下图。请回答:
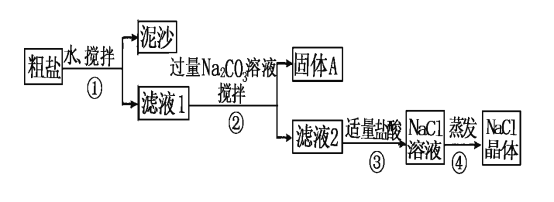
(1)步骤①和②的操作名称是________________。
(2)步骤②中判断加入碳酸钠是否过量的方法是_____________________
步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止__________________,当蒸发皿中有较多量固体出现时,应___________________________________。
(3)猜想和验证:
猜想 | 验证的方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | ___________ | 猜想Ⅰ成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入________,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | 猜想Ⅱ不成立 |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,__________ | __________________ | 猜想Ⅲ成立 |
(4)写出“猜想Ⅲ”中对应的化学反应方程式:______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知8 g A能与32 g B恰好完全反应,生成22 g C和一定量的D;现将16 g A与70 g B混合,充分反应后,生成2 mol D和一定量的C,则D的摩尔质量为__________。
(2) 标准状况下,0.5molH2和 O2的混合气体所占的体积为________。
(3)8.5 g氢氧根离子含有的电子数目为________。
(4)14 g C2H4与C4H8的混合物所含质子的物质的量为________。
(5)将4gNaOH溶于__________g水中,可使溶液中H2O与Na+的物质的量之比等于20:1,若测得该溶液的密度为1.1g/cm3,则该溶液中c(Na+)为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com