
(20分)某研究性学习小组在实验室中配制0.20mol·L-1的盐酸标准溶液,然后用其滴定某未知浓度的氢氧化钠溶液。
⑴配制待测液:将1.7 g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200 mL溶液,所需的主要玻璃仪器除烧杯,200 mL容量瓶,量筒,还有 ﹑ 。
⑵滴定:
①盛装0.20mol·L-1盐酸标准液应该用 式滴定管,
②滴定时,先向锥型瓶中加酚酞作为指示剂;再逐滴滴定,观察到 时为滴定终点。
③有关数据记录如下:
滴定序号 | 待测液体体积(mL) | 所耗盐酸标准液的体积(mL) | |
起始读数 滴定前 | 终点读数 | ||
1 | 20.00 | 0.50 | 20.40 |
2 | 20.00 | 6.00 | 26.10 |
3 | 20.00 | 4.00 | 24.00 |
数据处理:NaOH溶液的浓度为 mol·L-1,烧碱样品的纯度为 。(保留三位有效数字)
⑶试分析以下各项操作对实验结果的可能影响,用“偏高”﹑“偏低”或“无影响”等填空:
①若用蒸馏水冲洗锥形瓶,则会使测定的结果 ;
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果 ;
③若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果 ;
④读数时,若滴定前俯视读数,滴定后仰视读数,则会使测定结果 ;
(1)胶头滴管 、玻璃棒 ;
(2) ①酸式;② 红色变成无色且半分钟不恢复;③ 0.20mol·L-1 ; 94.1% ;
(3) ① 无影响 ;②偏高;③ 偏低;④ 偏高。
【解析】
试题分析:⑴配制待测液:将1.7 g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200 mL溶液,所需的主要玻璃仪器除烧杯,200 mL容量瓶,量筒,还有胶头滴管、玻璃棒;⑵ ①盐酸标准液应该用酸式滴定管;②滴定时,先向锥形瓶中加酚酞作为指示剂;再逐滴滴定,由于开始时酚酞在碱性溶液中,因此滴定前溶液为红色。当观察到滴加最后一滴盐酸,溶液由红色变成无色且半分钟不恢复时滴定达到了终点。③第一次滴加消耗体积为19.90ml;第二次滴加消耗体积为:20.10ml;第三次滴加消耗体积为20.00ml.因此平衡消耗HCl的体积为:(19.90ml+20.10ml+20.00ml)÷3=20.00ml。根据酸碱恰好完全中和时二者的物质的量相等可得c(NaOH)=c(HCl)·V(HCl)/v(NaOH)= (0.20mol/L×20.00ml) ÷20.00ml= 0.20 mol/L。n(NaOH)=0.20mol/L×0.02L×10=0.04mol.m(NaOH)=0.04mol×40g/mol=1.6g.所以NaOH的纯度为:(1.6g÷1.7g)×100%=94.1%。⑶①若用蒸馏水冲洗锥形瓶,由于在锥形瓶中碱是物质的量不变,所以不会使测定的结果产生误差。无影响。②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则消耗的标准酸溶液的体积偏大,以此为标准会使测定结果偏高。③若刚见到指示剂局部的颜色有变化就停止滴定,则消耗的标准酸溶液的体积就偏小,以此为标准计算的结果就偏低。④读数时,若滴定前俯视读数,开始读数偏小;滴定后仰视读数,滴定终点读数偏大,以此为标准计算的结果就偏高。
考点:考查酸碱中和滴定仪器的选择、使用、滴定终点的判断、误差分析、数据的处理、浓度、纯度的计算的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014江西八一中学、洪都中学下学期期中考试高一化学试卷(解析版) 题型:填空题
(7分) 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就三大酸与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解。该反应的化学方程式为:__________________________________。
(2)在一定体积的18 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积_________(填“大于”、“等于”或“小于”)100mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为______________。
(3)根据下图操作及现象推断酸X为_______(填序号)。
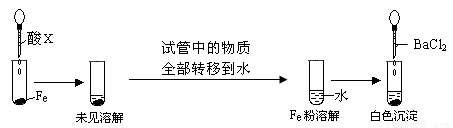
a.浓盐酸 b.浓硫酸 c.浓硝酸
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省盐城市高一下学期期末考试化学试卷(解析版) 题型:填空题
(12分)常见有机化合物转化关系如下图(部分反应条件已略去)。
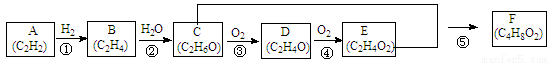
(1)A的结构式为 ;C中官能团的名称为 ;D物质的名称为 。
(2)属于取代反应的有 (填序号)。
(3)A光照生成G(分子式为C6H6),G分子中所有原子在同一平面,G既不能使酸性高锰酸钾溶液反应褪色,也不能使溴水反应褪色,则G的结构简式为 。
(4)H是E的同分异构体,能发生水解反应,H的结构简式可能为 。
(5)反应③的化学方程式为 ;反应⑤的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省盐城市高一下学期期末考试化学试卷(解析版) 题型:选择题
只用一种试剂就可鉴别乙酸、葡萄糖溶液、淀粉溶液,这种试剂是
A.NaOH溶液B.稀H2SO4
C.Cu(OH)2悬浊液D.Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省盐城市高一下学期期末考试化学试卷(解析版) 题型:选择题
绿色交通工具是指在行驶中对环境不发生污染或只发生微量污染的载客工具。下列不属于绿色交通工具的是

A.无轨电车B.氢气动力车 C.太阳能汽车 D.柴油汽车
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省第二学期期中考试高二化学试卷(解析版) 题型:选择题
一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)  ?2NH3(g) ΔH<0,反应过程如图:下列说法正确的是
?2NH3(g) ΔH<0,反应过程如图:下列说法正确的是

A.t1 min时正、逆反应速率相等。
B.X曲线表示NH3的物质的量随时间变化的关系
C.0~8 min,H2的平均反应速率v(H2)= mol·L-1·min-1
mol·L-1·min-1
D.10~12 min,升高温度使反应速率加快,平衡正向移动
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省第二学期期中考试高二化学试卷(解析版) 题型:选择题
在25 ℃时,密闭容器中X、Y、Z三种气体的浓度变化情况如图,下列说法错误的是

A.反应可表示为3X+Y 2Z
2Z
B.从反应开始到0.4 s时,以Y表示的化学反应速率为0.25 mol·L-1·s-1
C.增大压强使平衡向生成Z的方向移动,正逆反应速率均增大
D.升高温度,平衡常数一定增大
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省第二学期期中考试高一化学试卷(解析版) 题型:选择题
下列离子方程式不正确的是
A.过量的NaHSO4和Ba(OH)2溶液反应:2H++SO42—+Ba2++2OH—= BaSO4↓+2H2O
B.NH4HCO3和过量NaOH溶液相混合:HCO3—+OH—=CO32—+H2O
C.NaHSO4溶液中滴加氨水:H++NH3·H2O=NH4++H2O
D.向氨水中通入过量的SO2:NH3·H2O+SO2=NH4++HSO3—
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省淮安市高三5月信息卷化学试卷(解析版) 题型:实验题
(15分)Fe2O3俗称氧化铁红,常用作油漆着色剂。工业以煤矸石(主要成分:SiO2 49.5%;Fe2O3 20.6%;Al2O318.9%,以及MgO、FeO等其他杂质)制备并研究氧化铁红的应用。
(一)制备氧化铁红
1.预处理:将煤矸石粉碎,在350℃下焙烧2小时。
2.加酸溶【解析】
将预处理后的煤矸石溶于质量分数为15%过量的硫酸溶液中,过滤。在滤液中加入的H2O2。
3.调节pH:在上述滤液中加1mol/LNaOH溶液调节溶液的pH,再过滤,得到滤渣。
4.产品处理:将滤渣进行水洗、烘干、煅烧、研磨、过筛得产品。
已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 1.3 | 3.3 | 7.5 | 10.3 |
完全沉淀 | 2.8 | 5.2 | 9.7 | 12.2 |
请回答下列问题:
(1)预处理时,将煤矸石焙烧2小时的目的是 。
(2)酸浸操作中,过量H2SO4的作用是 。
在实验室中进行该操作时,用到玻璃仪器有 、 。
(3)用NaOH溶液调节pH的最佳范围是 。若从第二次过滤的滤液中获取较纯净的硫酸镁晶体,应补充的操作是 、洗涤后,干燥即得。
(4)产品处理时,对滤渣水洗的操作是 。
(二)分析与讨论:


(5)产品处理时,煅烧温度对产品的纯度有很大影响。已知温度对产物纯度的影响如图1所示,则煅烧时温度最好控制在 ℃。
(6)吸油量是反映氧化铁红表面性质的重要指标。吸油量大,说明氧化铁红表面积较大,则用在油漆中会造成油漆假稠,影响质量。不同浓度的两种碱溶液对产物吸油量影响如图2所示,则上述生产中在调节溶液pH时,选用NaOH溶液而不选用氨水的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com