
在25 ℃时,密闭容器中X、Y、Z三种气体的浓度变化情况如图,下列说法错误的是

A.反应可表示为3X+Y 2Z
2Z
B.从反应开始到0.4 s时,以Y表示的化学反应速率为0.25 mol·L-1·s-1
C.增大压强使平衡向生成Z的方向移动,正逆反应速率均增大
D.升高温度,平衡常数一定增大
D
【解析】
试题分析:有图像可知X、Y是反应物,Z是生成物。当反应进行到0.4s时达到平衡。各种物质的物质的量浓度变化是:X:0.3mol/L;Y:01mol/L;Z:0.2mol/L.所以化学方程式是3X+Y 2Z。正确。B.从反应开始到0.4 s时,以Y表示的化学反应速率为(0.2-0.1)mol/L÷0.4s=0.25 mol·L-1·s-1.正确。C.增大压强,物质的浓度增大,所以正逆反应速率均增大。由于该反应的正反应是气体体积减小的反应,增大压强,反应物的浓度增大的多,生成物的浓度增大的少,所以化学平衡会向气体体积减小的方向移动,即平衡向生成Z的方向移动。正确。D.升高温度,化学平衡向吸热反应方向移动,该反应的正反应可能是放热反应,也可能是吸热反应。若为放热反应,则升高温度,平衡逆向移动,平衡常数减小;若为吸热反应,则化学平衡常数增大。错误。
2Z。正确。B.从反应开始到0.4 s时,以Y表示的化学反应速率为(0.2-0.1)mol/L÷0.4s=0.25 mol·L-1·s-1.正确。C.增大压强,物质的浓度增大,所以正逆反应速率均增大。由于该反应的正反应是气体体积减小的反应,增大压强,反应物的浓度增大的多,生成物的浓度增大的少,所以化学平衡会向气体体积减小的方向移动,即平衡向生成Z的方向移动。正确。D.升高温度,化学平衡向吸热反应方向移动,该反应的正反应可能是放热反应,也可能是吸热反应。若为放热反应,则升高温度,平衡逆向移动,平衡常数减小;若为吸热反应,则化学平衡常数增大。错误。
考点:考查化学反应速率的计算、外界条件对化学反应速率、化学平衡的影响的知识。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源:2013-2014江西八一中学、洪都中学下学期期中考试高一化学试卷(解析版) 题型:选择题
有关氨的说法不正确的是
A.NH3是4核10电子的分子,三角锥形,具有还原性
B.NH3极易溶于水,可做喷泉实验;氨气易液化,液氨可用作制冷剂
C.氨气是非电解质,氨水是电解质
D.蘸有浓盐酸的玻璃棒遇氨气可产生白烟
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省盐城市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列变化中,吸收的热量用于克服分子间作用力的是
A.加热金属铝使之熔化
B.加热金刚石使之熔化
C.液溴受热变成溴蒸气
D.加热碘化氢使之分解
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省第二学期期中考试高二化学试卷(解析版) 题型:实验题
(20分)某研究性学习小组在实验室中配制0.20mol·L-1的盐酸标准溶液,然后用其滴定某未知浓度的氢氧化钠溶液。
⑴配制待测液:将1.7 g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200 mL溶液,所需的主要玻璃仪器除烧杯,200 mL容量瓶,量筒,还有 ﹑ 。
⑵滴定:
①盛装0.20mol·L-1盐酸标准液应该用 式滴定管,
②滴定时,先向锥型瓶中加酚酞作为指示剂;再逐滴滴定,观察到 时为滴定终点。
③有关数据记录如下:
滴定序号 | 待测液体体积(mL) | 所耗盐酸标准液的体积(mL) | |
起始读数 滴定前 | 终点读数 | ||
1 | 20.00 | 0.50 | 20.40 |
2 | 20.00 | 6.00 | 26.10 |
3 | 20.00 | 4.00 | 24.00 |
数据处理:NaOH溶液的浓度为 mol·L-1,烧碱样品的纯度为 。(保留三位有效数字)
⑶试分析以下各项操作对实验结果的可能影响,用“偏高”﹑“偏低”或“无影响”等填空:
①若用蒸馏水冲洗锥形瓶,则会使测定的结果 ;
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果 ;
③若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果 ;
④读数时,若滴定前俯视读数,滴定后仰视读数,则会使测定结果 ;
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省第二学期期中考试高二化学试卷(解析版) 题型:选择题
用食用白醋(醋酸浓度约为1 mol/L)进行下列实验,能证明醋酸为弱电解质的是
A.白醋中滴入石蕊试液呈红色 B.白醋加入豆浆中有沉淀产生
C.蛋壳浸泡在白醋中有气体放出 D.pH试纸显示醋酸的pH为2~3
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省第二学期期中考试高一化学试卷(解析版) 题型:填空题
(24分)下表是元素周期表的一部分,针对表中①~⑩种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 |
|
|
| ① | ② | ③ | ④ |
|
3 | ⑤ | ⑥ | ⑦ |
|
|
| ⑧ |
|
4 | ⑨ | ⑩ |
|
|
|
|
|
|
(1)被选作相对原子质量标准的核素是 (填核素符号)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是 。
(3)最高价氧化物是两性氧化物的元素在第 族;写出它的氧化物与氢氧化钠溶液反应的离子方程式 。
(4)从⑤到⑧的元素中, 原子半径最大(填元素符号)。
(5)元素④与⑥形成的化合物属于 (填 “共价”或“离子”)化合物。
(6)若要比较⑤比⑥的金属性强弱,下列实验方法可行的是 。
A、将单质⑤置于⑥的盐溶液中,如果⑤不能置换出单质⑥,说明⑤的金属性弱
B、比较⑤和⑥的最高价氧化物对应水化物的水溶性,前者比后者溶解度大,故前者金属性强
C、将⑤、⑥的单质分别投入到水中,观察到⑤与水反应更剧烈,说明⑤的金属性强
D、将⑤、⑥的单质分别在O2中燃烧,前者得到氧化物的颜色比后者得到氧化物的颜色深,则前者金属性强
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省第二学期期中考试高一化学试卷(解析版) 题型:选择题
肼(N2H4)是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是
A.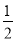 N2H4(g)+
N2H4(g)+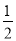 O2(g)===
O2(g)=== N2(g)+H2O(g) ΔH=+267 kJ·mol-1
N2(g)+H2O(g) ΔH=+267 kJ·mol-1
B.N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH=-133.5 kJ·mol-1
C.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
D.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+534 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省第二学期期中考试高一化学试卷(解析版) 题型:选择题
据报道,N4是一种形似白磷的分子,18O2是比黄金还贵重的物质。下列说法正确的是
A. 18O2 与16O2 性质完全相同 B.N4=2N2是化学变化
C. N4和N2互为同位素 D.18O2中含18个中子
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省淮安市高三5月信息卷化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
B.常温下,22gCO2和N2O混合气体中,含有的原子数目为1.5NA
C.标准状况下,2.24L甲醇中含有C—H键的数目为0.3NA
D.a mol·L—1的氯化铁溶液中,若Fe3+的数目为 NA,则Cl—的数目为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com