
| A、1 mol任何纯净物都含有相同的分子数 |
| B、1 mol氦气中约含有6.02×1023个氦原子 |
| C、1 mol水中含有8mol电子 |
| D、1 molNa的质量为23 g?mol-1 |


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
| A、是否为大量分子或离子的集合体 |
| B、分散质微粒直径的大小 |
| C、是否能通过滤纸或有丁达尔现象 |
| D、是否均一、稳定、透明 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与W相邻的同主族元素可制成重要的半导体材料 |
| B、元素原子半径从大到小的顺序是X、Y、Z |
| C、WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构 |
| D、W、Y、Z元素对应的氢化物稳定性最强的是H2Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
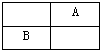
| A、A一定是第2周期元素 |
| B、B的原子半径一定比A大 |
| C、B的金属性一定比A强 |
| D、A的熔沸点一定比B高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体的分散质能通过滤纸空隙,而浊液的分散质不能 |
| B、胶体能产生丁达尔效应 |
| C、胶体分散质粒子直径在1nm~100nm之间 |
| D、胶体在一定条件下能稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
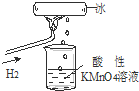 我校化学兴趣小组做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.则该条件下( )
我校化学兴趣小组做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.则该条件下( )| A、生成的水分子化学性质比较活泼 |
| B、H2燃烧生成了具有氧化性的物质 |
| C、H2被冷却为液态氢,液氢的水溶液具有还原性 |
| D、H2燃烧的产物中可能含有一定量的H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验中不慎打破温度计,可用吹风机加快水银的蒸发 |
| B、在气体发生装置上直接点燃甲烷气体时,必须先检验甲烷的纯度 |
| C、实验结束后,将废液倒入下水道排出实验室,以免污染实验室 |
| D、燃着的酒精灯不慎碰翻失火,应立即用水扑灭 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com