
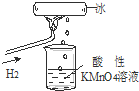
 我校化学兴趣小组做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.则该条件下( )
我校化学兴趣小组做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.则该条件下( )| A、生成的水分子化学性质比较活泼 |
| B、H2燃烧生成了具有氧化性的物质 |
| C、H2被冷却为液态氢,液氢的水溶液具有还原性 |
| D、H2燃烧的产物中可能含有一定量的H2O2 |


科目:高中化学 来源: 题型:
| 1 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol任何纯净物都含有相同的分子数 |
| B、1 mol氦气中约含有6.02×1023个氦原子 |
| C、1 mol水中含有8mol电子 |
| D、1 molNa的质量为23 g?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 铜 |
| B | 胆矾 | 石灰水 | 硫酸钡 | NH3 |
| C | 火碱 | 蔗糖溶液 | 氯化钠溶液 | 三氧化硫 |
| D | 纯醋酸 | 氢氧化铁胶体 | 苛性钾溶液 | 乙醇 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 预期实验现象和结论 |
| 若 若 若 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | R | ||||||||||||||||
| C | D | E | F | ||||||||||||||
| B | H | I | J | K | L | ||||||||||||
| G | M | N | T | ||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com