
【题目】氯及其化合物在生活和生产中应用广泛。
(1)已知:900 K时,4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g),反应自发。
2Cl2(g)+2H2O(g),反应自发。
①该反应是放热还是吸热,判断并说明理由___________________________。
②900 K时,体积比为4∶1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(p)变化曲线如图。保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在1.5×105~4.5×105Pa范围内,HCl的平衡转化率α(HCl)随压强(p)变化曲线示意图。_____________________

(2)已知:Cl2(g)+2NaOH(aq)===NaCl(aq)+NaClO(aq)+H2O(l) ΔHl=-102 kJ·mol-1
3Cl2(g)+6NaOH(aq)===5NaCl(aq)+NaClO3(aq)+3H2O(l) ΔH2=-422 kJ·mol-1
①写出在溶液中NaClO分解生成NaClO3的热化学方程式:________________________________。
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO-的浓度为c0 mol·L-1;加热时NaClO转化为NaClO3,测得t时刻溶液中ClO-浓度为ct mol·L-1,写出该时刻溶液中Cl-浓度的表达式:c(Cl-)=________________(用c0、ct表示)mol·L-1。
③有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-===ClO![]() + Cl-
+ Cl-
Ⅱ.ClO![]() +ClO-===ClO
+ClO-===ClO![]() +Cl-
+Cl-
常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:______________________________________________________。
【答案】 放热反应,ΔS<0且反应自发 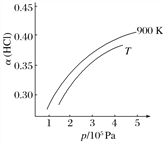 3NaClO(aq)===2NaCl(aq)+NaClO3(aq) ΔH=-116 kJ·mol-1 c0+
3NaClO(aq)===2NaCl(aq)+NaClO3(aq) ΔH=-116 kJ·mol-1 c0+![]() (或
(或![]() ) 反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO
) 反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO![]() 转化
转化
【解析】(1)①900Κ时,4HCl(g)+O22Cl2(g)+2H2O(g),△S<0,反应自发满足△H-T△S<0,△H<0,故答案为:放热,△S<0,反应自发满足△H-T△S<0;
②900K时,体积比为4:1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(P)变化曲线如图。保持其他条件不变,升温到TK,平衡逆向进行,HCl转化率减小,随压强增大平衡正向进行,HCl转化率增大,据此画出图象为: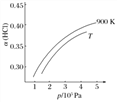 ,故答案为:
,故答案为: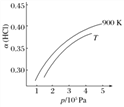 ;
;
(2)①Ⅰ.Cl2(g)+2NaOH(aq)=NaCl(aq)+NaClO(aq)+H2O(l)△Hl=-102kJmol-1,Ⅱ.3Cl2(g)+6NaOH(aq)=5NaCl(aq)+NaClO3(aq)+3H2O(1)△H2=-422kJmol-1,盖斯定律计算Ⅱ-Ⅰ×3得到NaClO分解生成NaClO3的热化学方程式:
3NaClO(aq)=2NaCl(aq)+NaClO3(aq)△H=-116KJ/mol,故答案为:3NaClO(aq)=2NaCl(aq)+NaClO3(aq)△H=-116KJ/mol;
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO-的浓度为c0molL-1,则Cl2(g)+2NaOH(aq)=NaCl(aq)+NaClO(aq)+H2O(l)反应中生成氯离子浓度为c0molL-1,加热时NaClO转化为NaClO3,测得t时刻溶液中ClO-浓度为c1molL-1,反应的次氯酸钠浓度=c0molL-1-c1molL-1
3NaClO(aq)=2NaCl(aq)+NaClO3(aq)
3 2
c0molL-1-c1molL-1 ![]() ×(c0molL-1-c1molL-1)
×(c0molL-1-c1molL-1)
该时刻溶液中Cl-浓度的表达式:c0molL-1+![]() ×(c0molL-1-c1molL-1 )=
×(c0molL-1-c1molL-1 )= ![]() ,故答案为:
,故答案为: ![]() ;
;
③③常温下,反应II能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,说明反应进行决定于反应Ⅰ,反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化,故答案为:反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
A. Al2O3熔点高,可用作耐高温材料
B. FeCl3溶液呈酸性,可用于腐蚀电路板上的Cu
C. 石墨具有导电性,可用于制铅笔芯
D. 浓硫酸具有强氧化性,可用于干燥CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学键的下列叙述中,正确的是( )
A. 离子化合物可能含共价键
B. 共价化合物可能含离子键
C. 离子化合物中只含离子键
D. 共价化合物中可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下有①6.72L甲烷②3.01×1023个氯化氢分子③13.6 g硫化氢④0.2 mol NH3。下列对这四种气体的关系从小到大表示不正确的是
A.体积:④<①<②<③ B.密度:①<④<③<②
C.质量:④<①<③<② D.氢原子数:②<④<③<①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(33As)在元素周期表中与氮、磷同主族,其在自然界存在的主要化合物有砒霜(As2O3)、雄黄( As4S4)、雌黄(As2S3)等。
(1)砷在元素周期表中的位置为________。
(2)在一定条件下,雄黄(As4S4(雄黄中As元素化合价为+2)和雌黄As2S3之间的转化关系如图所示。

①H3AsO3中砷元素呈_______价;则在转化关系I中,被还原的元素名称是____________。
②反应Ⅱ中,若1mol As4S4参加反应时,转移12mole-,则物质a为______(填化学式);将As2O3(俗称砒霜)在高温下用焦炭还原可制备砷,同时产生一种无毒气体,写出用焦炭还原As2O3时的化学方程式:_________。
③在转化关系Ⅲ中,将As2O3溶于热水生成亚砷酸(H3AsO3),已知H3AsO3是两性偏酸性的化合物,Na3AsO3溶液呈碱性,原因是_________(用水解离子方程式表示)。
(3)某原电池装置如图,电池总反应为AsO43-+2I-+H2O![]() AsO32-+I2+OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为___________。
AsO32-+I2+OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相存性方面有很好的应用前景。 PPG的一种合成路线如下:

已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃:化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④
回答下列问题:
(1)A的结构简式为 。
(2)由B生成C的化学方程式为 。
(3)由E和F生成G的反应类型为 ,G的化学名称为 。
(4)由D和H生成PPG的化学方程式为: 。(3分)
(5)写出D的同分异构体中能同时满足下列条件的有机物结构简式: 。
①能与饱和NaHCO3溶液反应产生气体 ②既能发生银镜反应,又能发生水解反应③核磁共振氢谱显示为3组峰,且峰面积比为6:1:1
(6)D的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是_________(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。则下列说法正确的是( )

A.Mg和Al的总质量为8 g
B.原稀硫酸溶液的物质的量浓度为5 mol·L-1
C.生成的H2在标准状况下的体积为11.2 L
D.NaOH溶液的物质的量浓度为5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4支试管中分别进行如下表所示实验,结论正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH |
B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
C | 滴加氯水和CCl4,振荡,静置 | 下层溶液显紫色 | 原溶液中有I- |
D | 通入过量CO2气体 | 生成白色沉淀 | 原溶液中只有AlO |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com