
【题目】常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法中正确的是( )
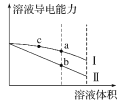
A.两溶液稀释前的浓度相同
B.a、b、c三点溶液的pH由大到小顺序为a>b>c
C.a点的Kw值比b点的Kw值大
D.a点水电离的c(H+)大于c点水电离的c(H+)
【答案】D
【解析】
稀释之前,两种溶液导电能力相等,说明离子浓度相等,由于醋酸为弱电解质,不能完全电离,则醋酸浓度大于盐酸浓度,加水稀释时,醋酸进一步电离,所以稀释过程中,醋酸导电能力大于盐酸,则Ⅰ为醋酸稀释曲线,Ⅱ为盐酸稀释曲线。
A.稀释之前,两种溶液导电能力相等,说明离子浓度相等,由于醋酸为弱电解质,不能完全电离,则醋酸浓度大于盐酸浓度,故A错误;
B.导电能力越大,说明离子浓度越大,酸性越强,则a、b、c三点溶液的pH大小顺序为c<a<b,故B错误;
C.相同温度下,Kw相同,a点的Kw等于b点的Kw值,故C错误;
D.a点离子浓度小于c点离子浓度,氢离子浓度越大,对水的电离抑制程度越大,则a点水电离的H+物质的量浓度大于c点水电离的H+物质的量浓度,故D正确。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。K2FeO4为紫色固体,微溶于KOH溶液。K2FeO4具有强氧化性,在酸性或中性溶液中迅速产生O2,在碱性溶液中较稳定。某学习小组设计了下面的实验制备K2FeO2并探究其性质。
Ⅰ.K2FeO4的制备
该小组用如图所示装置制备K2FeO4(夹持装置略)。
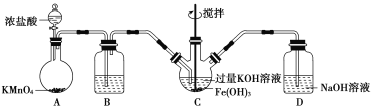
(1)以上装置图中有一处明显的错误请你帮助指出来:___________。B中应盛装的试剂是___________。
(2)写出A中发生反应的离子方程式__________________________________。
(3)C中发生的反应有Cl2+2OH-===Cl-+ClO-+H2O,还有生成K2FeO4的反应。写出得到紫色固体K2FeO4的化学方程式为____________。
Ⅱ.性质探究
用KOH溶液充分洗涤C中所得固体得到固体物质K2FeO4。
(4)絮凝实验:甲同学取少量K2FeO4加入浑浊的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。请结合方程式,说明K2FeO4的净水原理:_________________。
(5)乙同学取少量K2FeO4,向其中滴入稀盐酸发现产生黄绿色气体。产生黄绿色气体的原因可能是___。
(6)丙同学取少量K2FeO4,向其中滴入MnSO4和适量H2SO4的混合溶液,振荡后溶液呈紫色,丙同学认为氧化性FeO42->MnO4-。请你设计一个实验,验证丙同学的结论是否正确:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
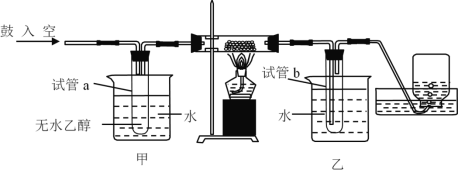
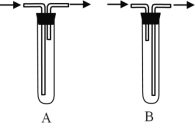
(1)试管a中导管连接方式为___________(填A或B)。
(2)实验过程中铜网出现黑色和红色交替的现象,其中铜丝由黑变红的反应方程式为_________。
(3)反应进行一段时间后,若要检验试管b中收集的物质,进行的操作为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
诺氟沙星为喹诺酮类抗生素,其合成路线如下:

回答下列问题:
(1)化合物A的名称是____________。
(2)诺氟沙星分子中含氧官能团的名称为____________。
(3)C生成D,H生成诺氟沙星的反应类型分别是___________、___________。
(4)F的结构简式为_______________。
(5)G生成H的化学方程式为__________________。
(6)有机物X比B分子少一个CH2原子团,且含有酯基和![]() 结构其中核磁共振氢谱有三组峰,峰面积比为1:3:3的结构简式为__________(任写一种)
结构其中核磁共振氢谱有三组峰,峰面积比为1:3:3的结构简式为__________(任写一种)
(7)参照上述合成路线写出由有机物![]() 、B为有机原料合成
、B为有机原料合成 的路线图______________(无机试剂任选)。
的路线图______________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的产物中,存在同分异构体的是
①CH3CH2CH2Br在碱性溶液中水解 ②甲苯在催化剂作用下与Cl2发生苯环上的取代反应 ③2-氯丁烷与NaOH乙醇溶液共热反应 ④ 在催化剂的存在与氢气完全加成 ⑤异戊二烯(
在催化剂的存在与氢气完全加成 ⑤异戊二烯( )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
A. ①②③ B. ①②④ C. ②③④ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洛索洛芬钠可用于类风湿性关节炎、肩周炎等炎症的消炎,其合成路线如图:
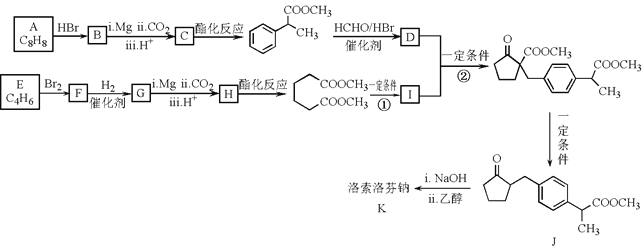
已知:ⅰ.RBr![]() RCOOH
RCOOH
ⅱ.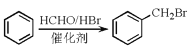
ⅲ. (以上R、R'、R'代表烃基)
(以上R、R'、R'代表烃基)
(1)A属于芳香烃,其结构简式是___。
(2)B的结构简式是___,D中含有的官能团是___。
(3)E属于烯烃。E与Br2反应生成F的化学方程式是___。
(4)反应①的化学方程式是___。
(5)反应②的反应类型是___。
(6)将J和NaOH溶液混合搅拌后,再加入乙醇有大量白色固体K析出,获得纯净固体K的实验操作是___;K的结构简式是___。
(7)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成聚丁二酸乙二醇酯(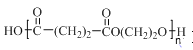 ),写出最多不超过5步的合成路线(用结构简式表
),写出最多不超过5步的合成路线(用结构简式表
示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往xg铁铜的混合粉末中加入一定体积某浓度的2.00mol·L-1FeCl3溶液,充分反应后剩余固体的质量与加入FeCl3溶液的体积存在如下关系:
加入FeCl3溶液体积(mL) | 100 | 200 | 300 | 400 |
剩余固体质量(g) | 14.8 | 9.20 | 3.20 | 0 |
下列说法不正确的是
A.x=20.6
B.加入FeCl3溶液300mL充分反应后,剩余固体只有Cu
C.混合粉末中Fe和Cu质量之比为35:16
D.加入FeCl3溶液400mL充分反应后的溶液,还能溶解铁粉8.40g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组测定不同温度下、不同初始浓度的某溶液中R的水解速率,c(R)随时间的变化曲线如图。下列说法不正确的是

A.在0-6min之间,25℃时R的水解速率为0.05 mol·L—1·min—1
B.在0-24min之间,曲线3对应水解速率最小
C.由曲线1可以得出结论:其它条件不变,水解速率随浓度增大而增大
D.由曲线2、3可以得出结论:其它条件不变,水解速率随温度升高而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,其中X、Y、W、Z为知周期元素,T的单质常温下为液体。下列说法错误的是

A. X、Y的单质均存在同素异形体
B. Y、Z的简单氢化物的稳定性依次递增
C. 工业上电解NaW溶液得W2可使用阴离子交换膜
D. R的单质可用于制造半导体材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com