
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。K2FeO4为紫色固体,微溶于KOH溶液。K2FeO4具有强氧化性,在酸性或中性溶液中迅速产生O2,在碱性溶液中较稳定。某学习小组设计了下面的实验制备K2FeO2并探究其性质。
Ⅰ.K2FeO4的制备
该小组用如图所示装置制备K2FeO4(夹持装置略)。
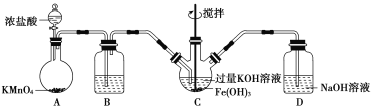
(1)以上装置图中有一处明显的错误请你帮助指出来:___________。B中应盛装的试剂是___________。
(2)写出A中发生反应的离子方程式__________________________________。
(3)C中发生的反应有Cl2+2OH-===Cl-+ClO-+H2O,还有生成K2FeO4的反应。写出得到紫色固体K2FeO4的化学方程式为____________。
Ⅱ.性质探究
用KOH溶液充分洗涤C中所得固体得到固体物质K2FeO4。
(4)絮凝实验:甲同学取少量K2FeO4加入浑浊的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。请结合方程式,说明K2FeO4的净水原理:_________________。
(5)乙同学取少量K2FeO4,向其中滴入稀盐酸发现产生黄绿色气体。产生黄绿色气体的原因可能是___。
(6)丙同学取少量K2FeO4,向其中滴入MnSO4和适量H2SO4的混合溶液,振荡后溶液呈紫色,丙同学认为氧化性FeO42->MnO4-。请你设计一个实验,验证丙同学的结论是否正确:_____________
【答案】D中没有出气导管 饱和氯化钠溶液 2MnO4-+16H++10Cl-===2Mn2++5Cl2↑+8H2O 3Cl2+2Fe(OH)3+10KOH===2K2FeO4+6KCl+8H2O K2FeO4与水发生反应 4FeO42-+10H2O===4Fe(OH)3(胶体)+3O2↑+8OH-,产生的 Fe(OH)3胶体可以吸附水中悬浮的杂质使水澄清 K2FeO4有强氧化性,将Cl-氧化为氯气 取少量紫色溶液滴加过量稀H2SO4,若溶液紫色不褪去,则丙同学的结论正确;若溶液紫色快速褪去,则丙同学的结论不正确
【解析】
Ⅰ.由图可知,A中浓盐酸与高锰酸钾发生2MnO4-+10Cl-+16H+═5Cl2↑+2Mn2++8H2O,可制备氯气,B中饱和食盐水可除去挥发的HCl,C中碱性条件下氯气与氢氧化铁反应生成K2FeO4,D中NaOH可吸收过量氯气;
Ⅱ.(4)K2FeO4具有强氧化性,且还原产物水解生成胶体;
(5)K2FeO4,向其中滴入稀盐酸发现产生黄绿色气体,气体为氯气,发生氧化还原反应;
(6)取少量K2FeO4,向其中滴入MnSO4和适量H2SO4的混合溶液,振荡后溶液呈紫色,可知生成高锰酸根离子,继续加硫酸可说明。
(1)题图装置图中D中只有进气导管,没有出气导管;高锰酸钾与浓盐酸反应产生的氯气中混有较多的氯化氢气体,对C中的反应有不良影响,因此,B中应盛装的试剂是饱和氯化钠溶液。
(2)高锰酸钾与浓盐酸反应产生氯气、KCl、MnCl2和水,根据电子守恒和原子守恒配平,A中的反应化学方程式为2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,离子方程式为2MnO![]() +16H++10Cl-===2Mn2++5Cl2↑+8H2O。
+16H++10Cl-===2Mn2++5Cl2↑+8H2O。
(3)C中Fe(OH)3、KOH和氯气反应生成K2FeO4,铁元素从+3价升高为+6价,被氧化,因此氯气作氧化剂,其还原产物是氯化钾,化学方程式为3Cl2+2Fe(OH)3+10KOH===2K2FeO4+6KCl+8H2O。
(4)甲同学取少量K2FeO4加入浑浊的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清,是因为K2FeO4与水发生反应 4FeO42-+10H2O===4Fe(OH)3(胶体)+3O2↑+8OH-,产生的Fe(OH)3胶体可以吸附水中悬浮的杂质使水澄清。
(5)乙同学取少量K2FeO4,向其中滴入稀盐酸发现产生黄绿色气体。产生黄绿色气体的原因可能是K2FeO4有强氧化性,将Cl-氧化为氯气。
(6)丙同学取少量K2FeO4,向其中滴入MnSO4和适量H2SO4的混合溶液,振荡后溶液呈紫色,说明生成了MnO4-,据题目所提供的资料可知K2FeO4具有强氧化性,在酸性或中性溶液中迅速产生O2,在碱性溶液中较稳定。为了验证丙同学的想法是否正确,可以取少量紫色溶液滴加过量稀H2SO4,若溶液紫色不褪去,则丙同学的结论正确;若溶液紫色快速褪去,则丙同学的结论不正确。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O ![]() Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是( )
A.放电时负极得电子,质量减轻
B.放电时负极附近的pH增大
C.充电时该电池的正极与外加电源的负极相连
D.充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是有机合成的一种重要还原剂。一般的制备方法是将AlC13溶于有机溶剂,再把所得溶液滴加到NaH粉末上,可制得铝氢化钠。实验要求和装置如下,回答下列问题:
(1)制取铝氢化钠要在非水溶液中进行,主要原因是_______(用化学方程式表示)。用下列装置制取少量铝氢化钠(含副产物处理)较为合理的是__________。

(2)对于原料A1C13的制取,某兴趣小组设计了如下装置:

①连接好装置后,应进行的第一步操作是_________;为保证产物的纯净,应待D中__________(填现象)再加热酒精灯。
②B装置中盛装饱和NaCl溶液,实验开始后B中产生的现象是_________,选择饱和NaCl溶液的理由是_____。
③C装置的作用是_________;若无C装置,试预测实验后D中生成物除A1C13外可能还含有_________。(填化学式)
④上述装置存在的明显缺陷是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为不同化学元素组成的化合物示意图,下列说法正确的是( )
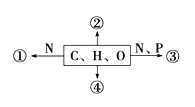
A. 若图中①为某种化合物的基本单位,则①最可能是核苷酸
B. 若②广泛分布在动物细胞内,则其一定是糖原
C. 若③为生物大分子,则其彻底水解产物最多为4种
D. 若④为重要储能物质,则动物和植物细胞都含有这种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在 KClO3 晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是 ( )
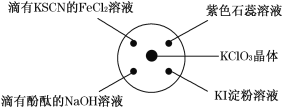
选项 | 实验现象 | 结论 |
A | 滴有 KSCN 的 FeCl2 溶液变红色 | Cl2 具有还原性 |
B | 滴有酚酞的 NaOH 溶液褪色 | Cl2 具有酸性 |
C | 淀粉 KI 溶液中变蓝色 | Cl2 具有氧化性 |
D | 石蕊溶液先变为红色后褪色 | Cl2 具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn + 2K2FeO4+ 8H2O![]() 3Zn(OH)2+ 2Fe(OH)3+ 4KOH,下列叙述正确的是
3Zn(OH)2+ 2Fe(OH)3+ 4KOH,下列叙述正确的是
A.放电时Zn是正极
B.放电时负极反应为:Zn-2e- +2OH- = Zn(OH)2
C.充电时Fe(OH)3被还原
D.充电时电解液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.在铁片上镀铜时,若阴极增重3.2g,则电镀液中通过的电子的物质的量为0.1mol
B.钢铁电化学腐蚀的两种类型主要区别在于水膜的PH不同,引起的负极反应不同
C.参加反应的物质的性质是决定化学反应速率的重要因素
D.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极区产生的Cl2进入阳极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氮化硅陶瓷材料可由石英固体与焦炭颗粒在高温氮气流中通过如下反应制得:SiO2+C+N2![]() Si3N4+CO(未配平)。该反应过程中的能量变化如图所示。回答以下问题:
Si3N4+CO(未配平)。该反应过程中的能量变化如图所示。回答以下问题:
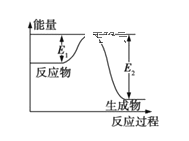
(1)上述反应中的氧化剂是___________,其还原产物是________________。
(2)该反应是____ (填“吸热反应”或“放热反应”),ΔH____(填“>、<、=”)0。
(3)该反应过程中,断裂旧键吸收的热量___ (填“>、<、=”)形成新键释放的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法中正确的是( )
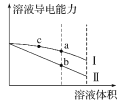
A.两溶液稀释前的浓度相同
B.a、b、c三点溶液的pH由大到小顺序为a>b>c
C.a点的Kw值比b点的Kw值大
D.a点水电离的c(H+)大于c点水电离的c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com