
【题目】往xg铁铜的混合粉末中加入一定体积某浓度的2.00mol·L-1FeCl3溶液,充分反应后剩余固体的质量与加入FeCl3溶液的体积存在如下关系:
加入FeCl3溶液体积(mL) | 100 | 200 | 300 | 400 |
剩余固体质量(g) | 14.8 | 9.20 | 3.20 | 0 |
下列说法不正确的是
A.x=20.6
B.加入FeCl3溶液300mL充分反应后,剩余固体只有Cu
C.混合粉末中Fe和Cu质量之比为35:16
D.加入FeCl3溶液400mL充分反应后的溶液,还能溶解铁粉8.40g
【答案】A
【解析】
向铁铜的混合粉末中加入一定体积某浓度的2.00mol·L-1FeCl3溶液,则由于铁的还原性比铜的强,故先发生反应2Fe3++2Fe=3Fe2+,再发生2Fe3++Cu=2Fe2++Cu2+,每100mL2.00mol·L-1FeCl3溶液中含有的FeCl3的物质的量为![]() ,通过比较表中100mL和200mL可知,固体质量减少了14.8g-9.20g=5.6g,说明200mL时均为铁与氯化铁反应,故前100mL也是铁和氯化铁反应,减少的质量也是5.6g,故x=14.8g+5.6g=20.4g,而比较表中200mL和300mL可知质量减少为9.20g-3.20g=6.00g,说明此时不仅仅发生铁与氯化铁的反应了,还有铜与氯化铁的反应,结合此分析进行解题。
,通过比较表中100mL和200mL可知,固体质量减少了14.8g-9.20g=5.6g,说明200mL时均为铁与氯化铁反应,故前100mL也是铁和氯化铁反应,减少的质量也是5.6g,故x=14.8g+5.6g=20.4g,而比较表中200mL和300mL可知质量减少为9.20g-3.20g=6.00g,说明此时不仅仅发生铁与氯化铁的反应了,还有铜与氯化铁的反应,结合此分析进行解题。
A.通过比较表中100mL和200mL可知,固体质量减少了14.8g-9.20g=5.6g,说明200mL时均为铁与氯化铁反应,故前100mL也是铁和氯化铁反应,减少的质量也是5.6g,故x=14.8g+5.6g=20.4g,A错误;
B. 比较表中200mL和300mL可知质量减少为9.20g-3.20g=6.00g,结合分析可知此时不仅仅发生铁与氯化铁的反应了,还有铜与氯化铁的反应,故加入FeCl3溶液300mL充分反应后,剩余固体只有Cu,B正确;
C. 假设第3个100mL的氯化铁溶液与n1mol的Fe,n2molCu反应结合反应2Fe3++2Fe=3Fe2+, 2Fe3++Cu=2Fe2++Cu2+,可以列式:①2n1+2n2=0.2mol,②56n1+64n2=6.0g,解得:n1=0.05mol,n2=0.05mol,故混合粉末中Fe和Cu质量之比为(2×5.6g+0.05mol×56g/mol):(3.2g+0.05mol×64g/mol)=35:16,C正确;
D. 与300mL相比较,可知加入FeCl3溶液400mL充分反应后的溶液中氯化铁有剩余,剩余的氯化铁还能再溶解铁粉的质量为6.0g-3.2g=2.8g,若再加入2.8g铁粉后溶液中就只有Cu2+能继续与Fe反应了,根据反应Fe+Cu2+=Fe2++Cu2+,结合C的分析可知,还能溶解铁粉为![]() ,故加入FeCl3溶液400mL充分反应后的溶液还能溶解铁粉为5.6g+2.8g=8.4g,D正确;
,故加入FeCl3溶液400mL充分反应后的溶液还能溶解铁粉为5.6g+2.8g=8.4g,D正确;
故答案为:A。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.在铁片上镀铜时,若阴极增重3.2g,则电镀液中通过的电子的物质的量为0.1mol
B.钢铁电化学腐蚀的两种类型主要区别在于水膜的PH不同,引起的负极反应不同
C.参加反应的物质的性质是决定化学反应速率的重要因素
D.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极区产生的Cl2进入阳极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 表示阿伏加德罗常数的值,下列判断正确的是( )
表示阿伏加德罗常数的值,下列判断正确的是( )
A.常温下,![]() 的盐酸溶液中,由水电离的
的盐酸溶液中,由水电离的![]() 个数为
个数为![]()
B.标准状况下,氧原子总数为![]() 的
的![]() 和
和![]() 的混合气体,其体积为
的混合气体,其体积为![]()
C.常温下,![]() 铁分别与足量氯气和稀硝酸反应,转移的电子数目均为
铁分别与足量氯气和稀硝酸反应,转移的电子数目均为![]()
D.![]() 乙醇溶液中所含
乙醇溶液中所含![]() 数目为NA
数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法中正确的是( )
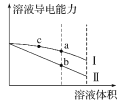
A.两溶液稀释前的浓度相同
B.a、b、c三点溶液的pH由大到小顺序为a>b>c
C.a点的Kw值比b点的Kw值大
D.a点水电离的c(H+)大于c点水电离的c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚碳酸酯( )的透光率良好。它可制作车、船、飞机的挡风玻璃,以及眼镜片、光盘、唱片等。它可用绿色化学原料X(
)的透光率良好。它可制作车、船、飞机的挡风玻璃,以及眼镜片、光盘、唱片等。它可用绿色化学原料X(![]() )与另一原料Y反应制得,同时生成甲醇。下列说法不正确的是
)与另一原料Y反应制得,同时生成甲醇。下列说法不正确的是
A. Y的分子结构中有2个酚羟基 B. Y的分子式为C15H18O2
C. X的核磁共振氢谱有1个吸收峰 D. X、Y生成聚碳酸酯发生的是缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】D是一种催眠药,F是一种香料,它们的合成路线如下:

(1)A的化学名称是___,C中含氧官能团的名称为___。
(2)F的结构简式为___。
(3)A生成B的化学方程式为___。
(4)写出C合成D的第二个反应的化学方程式___。
(5)同时满足下列条件的E的同分异构体有___种(不含立体异构)。
①遇FeCl3溶液发生显色反应 ②能发生银镜反应
(6)以乙炔和甲醛为起始原料,选用必要的无机试剂合成1,3-丁二烯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___
HC≡CH![]()

![]()
![]() CH2=CHCH=CH2
CH2=CHCH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行以下实验:
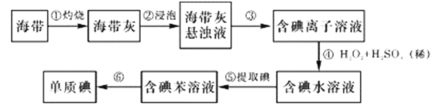
请填写下列空白:
(1)步骤③的操作名称是__________________,碘离子在酸性环境中也能被氧气氧化,请写出相关离子方程式是________________________________________。
(2)步骤⑤中萃取剂也可用四氯化碳的理由是_____________________________,该步骤所用主要玻璃仪器的名称是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如表:
元素代号 | X | Y | Z | W | Q |
原子半径 | 160 | 143 | 70 | 66 | 104 |
主要化合价 |
|
|
|
|
|
下列选项正确的是( )
A.X、Y元素的金属性![]()
B.一定条件下,Z单质与W的常见单质直接生成![]()
C.Y的最高价氧化物对应的水化物能溶于氨水
D.Q与W形成的一种化合物可用作纸张漂白剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白。亚氯酸钠![]() 在溶液中可生成
在溶液中可生成![]() 、
、![]() 、
、![]() 、
、![]() 等,其中
等,其中![]() 和
和![]() 都具有漂白作用,但
都具有漂白作用,但![]() 是有毒气体;经测定,
是有毒气体;经测定,![]() 时各组分含量随pH变化情况如图所示
时各组分含量随pH变化情况如图所示![]() 没有画出
没有画出![]() 则下列分析正确的是( )
则下列分析正确的是( )

A.亚氯酸钠在酸性条件下较稳定
B.![]() 时,
时,![]() 的电离平衡常数的数值
的电离平衡常数的数值![]()
C.pH越大,该漂白剂的漂白性能越好
D.![]() ,
,![]() 时,
时,![]() 溶液中:
溶液中:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com