
【题目】海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行以下实验:
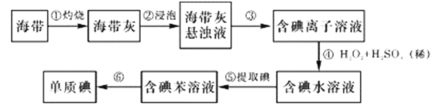
请填写下列空白:
(1)步骤③的操作名称是__________________,碘离子在酸性环境中也能被氧气氧化,请写出相关离子方程式是________________________________________。
(2)步骤⑤中萃取剂也可用四氯化碳的理由是_____________________________,该步骤所用主要玻璃仪器的名称是_________________。
【答案】过滤 4H++4I-+O2=====2I2+2H2O 四氯化碳与水不相溶,且溴在四氯化碳中的溶解度远大于在水中的溶解度 分液漏斗
【解析】
海带经过灼烧后得到海带灰,浸泡海带灰,得到海带灰悬浊液,过滤,除去难溶性杂质,得到含碘离子的溶液,在酸性环境下,用过氧化氢氧化碘离子得到含碘水的溶液,再用苯萃取碘水中的碘单质得到含碘的苯溶液,再进行蒸馏,得到碘单质。
(1)由以上分析知,步骤③的操作是过滤,除去难溶性杂质,得到含碘离子的溶液;碘离子在酸性环境中也能被氧气氧化,该反应的离子方程式是4H++4I-+O2=====2I2+2H2O;
(2)步骤⑤中萃取剂也可用四氯化碳,是因为四氯化碳与水不相溶,且溴在四氯化碳中的溶解度远大于在水中的溶解度;萃取过程所用的主要玻璃仪器为分液漏斗。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实 验 步 骤 | 解 释 或 实 验 结 论 |
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: (1)A的相对分子质量为:____。 |
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为:_______。 |
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团:___________。 |
(4)A的核磁共振氢谱如下图:
| (4)A中含有________种氢原子。 |
(5)综上所述,A的结构简式_____________。 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的产物中,存在同分异构体的是
①CH3CH2CH2Br在碱性溶液中水解 ②甲苯在催化剂作用下与Cl2发生苯环上的取代反应 ③2-氯丁烷与NaOH乙醇溶液共热反应 ④ 在催化剂的存在与氢气完全加成 ⑤异戊二烯(
在催化剂的存在与氢气完全加成 ⑤异戊二烯( )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
A. ①②③ B. ①②④ C. ②③④ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往xg铁铜的混合粉末中加入一定体积某浓度的2.00mol·L-1FeCl3溶液,充分反应后剩余固体的质量与加入FeCl3溶液的体积存在如下关系:
加入FeCl3溶液体积(mL) | 100 | 200 | 300 | 400 |
剩余固体质量(g) | 14.8 | 9.20 | 3.20 | 0 |
下列说法不正确的是
A.x=20.6
B.加入FeCl3溶液300mL充分反应后,剩余固体只有Cu
C.混合粉末中Fe和Cu质量之比为35:16
D.加入FeCl3溶液400mL充分反应后的溶液,还能溶解铁粉8.40g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下, AgBr的Ksp=4.9×10-13,AgI的 Ksp=8.3×10-17。
(1)AgBr固体在水中达到溶解平衡,写出溶解平衡表达式 _______________________;此时溶液中c(Ag+)=___________________;
(2)向AgBr的悬浊液中加入KI固体则 c(Br-)_____________。 (填“变大”、“变小”或“不变”);
(3)某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:


①酸浸后加入H2O2的目的是____________ ,调pH的最适宜范围为________________。
②调pH过程中加入的试剂合理的是_________。
a.NaOH b.CuO c.NH3·H2O d.Cu2(OH)2CO3
③向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,反应的离子方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组测定不同温度下、不同初始浓度的某溶液中R的水解速率,c(R)随时间的变化曲线如图。下列说法不正确的是

A.在0-6min之间,25℃时R的水解速率为0.05 mol·L—1·min—1
B.在0-24min之间,曲线3对应水解速率最小
C.由曲线1可以得出结论:其它条件不变,水解速率随浓度增大而增大
D.由曲线2、3可以得出结论:其它条件不变,水解速率随温度升高而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面两图均为原电池装置,有关说法错误的是( )
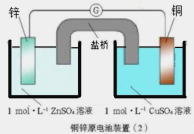
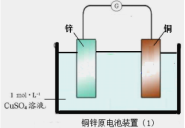
A.锌比铜活泼,锌为负极,发生氧化反应
B.电流从铜电极经导线流向锌电极
C.铜电极发生的反应为:Cu-2e-= Cu2+
D.装置(2)比装置(1)更能清楚揭示出电池中发生的化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近几年我国已加大对氮氧化物排放的控制力度。消除氮氧化物污染有多种方法。
(l)用CH4还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
②CH4(g)+4NO (g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
③H2O(g)= H2O(l) △H=-44.0kJ·mol-1
CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式为_________________。
(2)用活性炭还原法也可处理氮氧化物。有关反应为:2C(s)+2NO2(g)=N2(g)+2CO2(g) △H<0,起始时向密闭容器中充入一定量的C(s)和NO2(g),在不同条件下,测得各物质的浓度变化状况如下图所示。

①010min内,以CO2表示的平均反应速率v(CO2)=_______________。
②0~10min,1020 min,3040 min三个阶段NO2的转化率分别为α1、α2、α3,其中最小的为_________,其值是___________________。
③计算反应达到第一次平衡时的平衡常数K=____________。
④第10min时,若只改变了影响反应的一个条件,则改变的条件为______(填选项字母)。
A.增加C(s)的量 B.减小容器体积 C.加入催化剂
⑤20~30min、4050 min时体系的温度分别为T1和T2,则T1_____T2(填“> “<”或“=”), 判断的理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙烯为原料合成化合物C的流程如图所示:
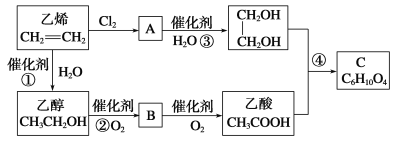
(1)①③的反应类型分别为___反应和___反应。
(2)写出反应③和④的化学方程式:
③____;④___。
(3)写出B与银氨溶液反应的化学方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com