
【题目】已知常温下, AgBr的Ksp=4.9×10-13,AgI的 Ksp=8.3×10-17。
(1)AgBr固体在水中达到溶解平衡,写出溶解平衡表达式 _______________________;此时溶液中c(Ag+)=___________________;
(2)向AgBr的悬浊液中加入KI固体则 c(Br-)_____________。 (填“变大”、“变小”或“不变”);
(3)某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:


①酸浸后加入H2O2的目的是____________ ,调pH的最适宜范围为________________。
②调pH过程中加入的试剂合理的是_________。
a.NaOH b.CuO c.NH3·H2O d.Cu2(OH)2CO3
③向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,反应的离子方程式_____________。
【答案】AgBr(s) Ag+(aq)+Br-(aq) 7×10-7mol/L 变大 将Fe2+氧化为Fe3+,便于调整pH使其与Cu2+分离 3.2~4.4 BD 2Cu2++2Cl-+SO32-+H2O=2CuCl↓+SO42-+2H+
【解析】
(1)依据溶解平衡书写方程式即可;依据溶度积计算浓度;
(2)根据影响沉淀溶解平衡的因素:浓度、同离子效应等进行判断。.
(3)电镀污泥中含有铜、铁等金属化合物。用酸浸取,再用双氧水氧化,可得硫酸铜和硫酸铁的混合溶液,调节PH值,使铁离子产生氢氧化铁沉淀,过滤得氢氧化铁固体,再将氢氧化铁固体加热分解得氧化铁,过滤得滤液中含有硫酸铜,向CuSO4溶液中加入一定量的NaCl、Na2SO3,将铜离子还原成亚铜离子,生成白色的CuCl沉淀。
①由表中氢氧化物开始沉淀剂沉完全的pH,可知通过调节pH不能将亚铁离子与铜离子分离,而调节pH可以使铁离子与铜离子分离;
②调pH步骤中加入的试剂最好是加入某种物质除去溶液中的酸且不引进新的杂质;
③Cu2+将SO32-氧化为SO42-,自身被还原为Cu+,Cu+与Cl-结合生成CuCl沉淀;
(1)AgBr固体在水中溶解平衡的表达式为:AgBr(s)Ag+(aq)+Br -(aq),依据其Ksp=4.9×10-13即:Ksp=c(Ag+)c(Br-),因为c(Ag+)=c(Br-),故![]() mol/l
mol/l
故答案为:AgBr(s) Ag+(aq)+Br-(aq);7×10-7;
(2)根据溴化银的沉淀溶解平衡:AgBr(s)Ag+(aq)+Br-(aq),加KI固体,则碘离子和银离子之间反应,会转化为更难溶的沉淀碘化银,所以银离子浓度减小,平衡右移,溴离子浓度增大,
故答案为:变大;
(3)由表中氢氧化物开始沉淀剂沉完全的pH,可知通过调节pH不能将亚铁离子与铜离子分离,而调节pH可以使铁离子与铜离子分离,酸浸后加入H2O2的目的是:将Fe2+氧化成Fe3+,便于调整pH使其与Cu2+分离,
故答案为:将Fe2+氧化成Fe3+,便于调整pH使其与Cu2+分离;
(2)调pH步骤中加入的试剂最好是加入某种物质除去溶液中的酸且不引进新的杂质,所加试剂可以为:CuO、Cu(OH)2、CuCO3等,
故选:BD;
(3)Cu2+将SO32氧化为SO42,自身被还原为Cu+,,Cu+与Cl结合生成CuCl沉淀,反应离子方程式为:2Cu2++2Cl-+SO32-+H2O=2CuCl↓+SO42-+2H+,
故答案为:2Cu2++2Cl-+SO32-+H2O=2CuCl↓+SO42-+2H+。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 沸点:邻二甲苯>间二甲苯>对二甲苯
B. 鸡蛋淸在NH4Cl溶液中能发生盐析,但是不能和盐酸发生化学反应
C.  有机物A的分子式为C16H16O3
有机物A的分子式为C16H16O3
D.  滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烯雌酚是一种激素类药物,结构如下.下列有关叙述中不正确的是( )

A. 它易溶于有机溶剂
B. 可与NaOH和NaHCO3发生反应
C. 1mol该有机物可以与5molBr2发生反应
D. 该有机物分子中,可能有16个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚碳酸酯( )的透光率良好。它可制作车、船、飞机的挡风玻璃,以及眼镜片、光盘、唱片等。它可用绿色化学原料X(
)的透光率良好。它可制作车、船、飞机的挡风玻璃,以及眼镜片、光盘、唱片等。它可用绿色化学原料X(![]() )与另一原料Y反应制得,同时生成甲醇。下列说法不正确的是
)与另一原料Y反应制得,同时生成甲醇。下列说法不正确的是
A. Y的分子结构中有2个酚羟基 B. Y的分子式为C15H18O2
C. X的核磁共振氢谱有1个吸收峰 D. X、Y生成聚碳酸酯发生的是缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应原理,可以进行苯甲酸甲酯的合成。有关物质的物理性质、实验装置如下所示:
苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
熔点/℃ | 122.4 | ﹣97 | ﹣12.3 |
沸点/℃ | 249 | 64.3 | 199.6 |
密度/g.cm﹣3 | 1.2659 | 0.792 | 1.0888 |
水溶性 | 微溶 | 互溶 | 不溶 |
实验一:制取苯甲酸甲酯
在大试管中加入15g苯甲酸和一定量的甲醇,边振荡边缓慢加入一定量浓硫酸,按图A连接仪器并实验。

(1)苯甲酸与甲醇反应的化学方程式为______________________________________。
(2)中学实验室中制取乙酸乙酯时为了提高酯的产率可以采取的措施有___________________________
实验二:提纯苯甲酸甲酯
该实验要先利用图B装置把图A中制备的苯甲酸甲酯水洗提纯,再利用图C装置进行蒸馏提纯
(3)用图B装置进行水洗提纯时,B装置中固体Na2CO3作用是__________________。
(4)用图C装置进行蒸馏提纯时,当温度计显示____________时,可用锥形瓶收集苯甲酸甲酯。
(5)最终制取15g苯甲酸甲酯,计算得苯甲酸甲酯的产率为______________(小数点后保留1位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行以下实验:
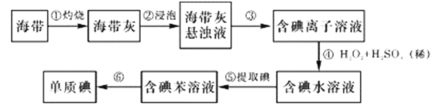
请填写下列空白:
(1)步骤③的操作名称是__________________,碘离子在酸性环境中也能被氧气氧化,请写出相关离子方程式是________________________________________。
(2)步骤⑤中萃取剂也可用四氯化碳的理由是_____________________________,该步骤所用主要玻璃仪器的名称是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,分别向容积固定的密闭容器中充入A和足量B,发生反应如下:2A(g)+B(s)![]() 2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是
2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是
实验Ⅰ | 实验Ⅱ | 实验Ⅲ | |
反应温度/℃ | 800 | 800 | 850 |
c(A)起始/mol·L-1 | 1 | 2 | 1 |
c(A)平衡/mol·L-1 | .0.5 | 1 | 0.85 |
放出的热量/kJ | a | b | c |
A.实验III的化学平衡常数K<1
B.实验放出的热量关系为b>2a
C.实验III在30min达到平衡时的速率v(A)为0.005mol L-1·min-1
D.当容器内气体密度不随时间而变化时上述反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质属于同系物的是( )
A. ![]() 与
与![]() B. CH3CH2Cl与CH2ClCH2CH2Cl
B. CH3CH2Cl与CH2ClCH2CH2Cl
C. C2H5OH与CH3OH D. CH3CH2CH3与CH2=CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A的相对分子质量为甲烷的6.75倍。取10.8g有机化合物A,在足量氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重7.2g,氢氧化钠增重30.8g。
(1)试计算该有机物的分子式。(写出计算过程)___
(2)红外光谱测定,A分子结构中含有苯环和羟基。在常温下A可与浓溴水反应,1molA最多可与2molBr2作用,据此确定该有机物可能的结构简式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com