
【题目】纯净的过氧化钙(CaO2)是白色的结晶粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。在实验室可用钙盐制取CaO28H2O,再经脱水制得CaO2。CaO28H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2。其制备过程如下:
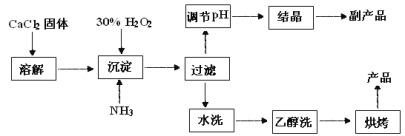
回答下列问题:
(1)用上述方法制取CaO28H2O的化学方程式是 。为了控制沉淀温度为0℃左右,在实验室宜采取的方法是 。
(2)该制法的副产品为 (填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是 。
(3)为了检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加 。
(4)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:用浓度为c mol/L的Na2S2O3溶液进行滴定,消耗Na2S2O3溶液V mL。
(已知:I2+2S2O32-=2I-+S4O62-)
①第三步中滴定终点的现象是 ;
②CaO2的质量分数为 (用字母表示)。
(5)已知CaO2在350℃迅速分解生成CaO和O2。某实验小组设计下图装置测定产品中CaO2含量(夹持装置省略)。
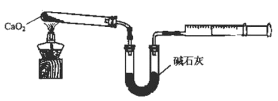
①若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为 (用字母表示)。
②CaO2的含量也可用重量法测定,需要测定的物理量有 。
【答案】(1)CaCl2+H2O2+2NH3+8H2O=CaO28H2O↓+2NH4Cl;冰水浴冷却(或将反应容器浸泡在冰水中);
(2)NH4Cl,HCl;(3)稀硝酸酸化的硝酸银溶液 ;
(4)①当滴入最后一滴Na2S2O3溶液时,溶液恰好由蓝色变为无色,且半分钟内不恢复;
②![]() ;
;
(5)①![]() ②样品质量、样品完全分解后剩余固体质量。
②样品质量、样品完全分解后剩余固体质量。
【解析】
试题分析:(1)根据流程图,根据沉淀反应中加入物质,因此反应方程式为:CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl;根据信息,CaO2·8H2O在0℃时稳定,因此实验室采取冰水浴冷却;(2)根据(1)的反应方程式,副产品为NH4Cl,稀产品表面有NH4Cl,检验是否洗净,需要检验Cl-,硝酸酸化的硝酸银溶液;(4)①根据反应离子反应方程式,消耗碘单质,淀粉遇碘变蓝,因此:当滴入最后一滴Na2S2O3溶液时,溶液恰好由蓝色变为无色,且半分钟内不恢复 ;②消耗n(I2)=Vc×10-3/2mol,根据得失电子守恒,n(CaO2)×2=Vc×10-3×2/2,解得n(CaO2)= Vc×10-3/2mol,CaO2的质量分数为Vc×10-3×72/2×100%=![]() ;(5)①2CaO2=2CaO+O2↑,m(CaO2)=76×2×V×10-3/22.4g,质量分数为72×2×V×10-3/(22.4×m)×100%=
;(5)①2CaO2=2CaO+O2↑,m(CaO2)=76×2×V×10-3/22.4g,质量分数为72×2×V×10-3/(22.4×m)×100%=![]() ;②样品质量、样品完全分解后剩余固体质量。
;②样品质量、样品完全分解后剩余固体质量。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A.根据对角线规则,铍和铝的性质具有相似性
B.在H3O+、NH4+ 和Cu(NH3)4]2+中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.P4和CH4都是正四面体分子且键角都为109o28ˊ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电池的研究一直是化学工作者研究的热点之一.
Ⅰ.美国科学家S鲁宾成功开发锌汞纽扣式电池,以锌和氧化汞为电极材料,氢氧化钾溶液为电解液的原电池,有效地解决电池使用寿命短,易发生漏液等问题.电池总反应为:Zn+HgO═ZnO+Hg。
(1)该电池的正极反应式为 。
(2)含汞电池生产企业的污水中会含有一定量的+2价的汞离子,通常采用处理成本较低的硫化物沉淀法,即向污水中投入一定量的硫化钠,反应的离子方程式为 。
(3)该方法的缺点是产物的颗粒比较小,大部分悬浮于污水中,通常采用投入一定量的明矾晶体进行后续处理,请解释其原因 。
Ⅱ.锂离子电池由于轻便、比能量大等优点,成为当今社会最为常见的电池.其中的重要材料磷酸亚铁锂(LiFePO4)通常按照下列流程进行生产:

请回答下列问题:
(4)生产过程中“混合搅拌”的目的是 。气体X的化学式为 。
(5)请写出一定条件下由LiH2PO4生成LiFePO4的化学方程式 ,当生成1mol磷酸亚铁锂时,转移的电子数目为 。
(6)生成LiFePO4的过程可能产生一种杂质对电池有致命的影响,则该杂质可能为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①泥浆中泥沙是溶质,水是溶剂。
②胶体的介稳性主要是因为胶体粒子可以通过吸附而带有电荷。
③凡是分散质能通过半透膜的分散系即属于胶体。
④通过丁达尔现象可以鉴别胶体和溶液。
A. ①②③④ B. ②④ C. ②③ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是( )
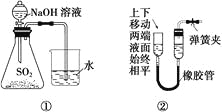
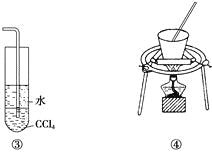
A. 装置①可用于证明SO2与NaOH溶液发生了反应
B. 装置②可证明装置的气密性良好
C. 装置③可用于吸收NH3或HCl气体,并防止倒吸
D. 装置④可用于实验室从食盐水中提取氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是 。
(2)写出步骤Ⅱ中Co2O3与盐酸反应的离子方程式 。有同学认为Ⅱ中将盐酸换成硫酸和H2O2溶液更好,请结合离子方程式说明理由 。
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过__________。废渣中的成分有_________________。
(4)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种二元化合物,该化合物中钴元素的质量分数为73.44%。此过程发生反应的化学方程式是_______________。
(5)某锂离子电池的总反应为C6+LiCoO2 ![]() LixC6+Li1-xCoO2,LixC6中Li的化合价为______价,该锂离子电池充电时阳极的电极反应式为 。
LixC6+Li1-xCoO2,LixC6中Li的化合价为______价,该锂离子电池充电时阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂质(括号中物质为杂质)所用试剂或方法不正确的是( )
A. CO2(CO):O2
B. MgO(Al203): NaOH溶液
C. NaHCO3溶液(Na2CO3):过量的C02
D. C02( HCl): 饱和NaHC03溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某分子的球棍模型如下图所示。已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。下列有关说法中错误的是( )
![]()
A.X原子可能为第ⅤA族元素
B.Y原子一定为第ⅠA族元素
C.该分子中既含有极性共价键又含有非极性共价键
D.从圆球的大小分析,该分子可能为N2F4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com