
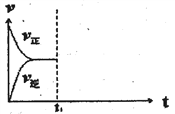
����Ŀ����ij�ܱ������м���0.3molA��0.1molC��һ������B�������壬һ�������·������·�Ӧ��3A(g)![]() B(g)+2C(g)�������ʵ�Ũ����ʱ��仯��ͼ��ʾ[t0��t1�ε�c(B)�仯δ����]������˵������ȷ����
B(g)+2C(g)�������ʵ�Ũ����ʱ��仯��ͼ��ʾ[t0��t1�ε�c(B)�仯δ����]������˵������ȷ����

A. ��t1=15s������A��Ũ�ȱ仯��ʾt0��t1�ε�ƽ����Ӧ����Ϊ0.004 mol/(L��s)
B. t1ʱ�÷�Ӧ�ﵽƽ�⣬A��ת����Ϊ40%
C. ���������ݻ�Ϊ2L��B����ʼ�����ʵ���Ϊ0.02 mol
D. t0��t1�Σ��˹����������������Ƚ�������Ϊa kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ3A(g)![]() B(g)+2C(g) ��H=-50a/3 kJ/mol
B(g)+2C(g) ��H=-50a/3 kJ/mol
���𰸡�D
��������A.����v����c/��t���㣻
B.����A����ʼ����ת��������ת���ʣ�
C.����B��ƽ�����ͱ仯�����㣻
D.����A����������������仯���㷴Ӧ�ȡ�
A.t0��t1�Σ�A��Ũ�ȱ仯Ϊ0.15mol/L-0.06mol/L=0.09 mol/L��t0��t1�ε�ƽ����Ӧ����Ϊ0.09mol/L��15s=0.006 mol��L��1��s��1��A����
B.t1ʱ�÷�Ӧ�ﵽƽ�⣬����ѡ��A�з�����֪A��ת����Ϊ0.09/0.15��100%=60%��B����
C.���ݷ�Ӧ3A(g)![]() B(g)��2C(g)��֪����Ӧ��ƽ����c(A)=0.09 mol��L��1�����c(B)=O.03 mol��L��1����ͼ���֪��Ӧ��ƽ���c(B)=0.05 mol��L��1������B����ʼ��Ũ��Ϊ0.02 mol��L��1��B����ʼ�����ʵ���Ϊ0.02mol/L��2L=0.04 mol��C����
B(g)��2C(g)��֪����Ӧ��ƽ����c(A)=0.09 mol��L��1�����c(B)=O.03 mol��L��1����ͼ���֪��Ӧ��ƽ���c(B)=0.05 mol��L��1������B����ʼ��Ũ��Ϊ0.02 mol��L��1��B����ʼ�����ʵ���Ϊ0.02mol/L��2L=0.04 mol��C����
D.t0��t1�Σ���c(A)=0.09 mol��L��1����n(A)=0.09mol/L��2L=0.18 mol����ʱ����a kJ�������3 mol A��ȫ��Ӧ������Ϊ50a/3 kJ�����Ȼ�ѧ����ʽΪ3A(g)![]() B(g)��2C(g) ��H����50a/3 kJ��mol��1��D��ȷ��
B(g)��2C(g) ��H����50a/3 kJ��mol��1��D��ȷ��
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��Ϊ�о�ԭ���ԭ���������ͼװ�á�������������ȷ����

A. a��b������ʱ��Fe����������ɫ����
B. a��b����ʱ��SO42-��Fe���ƶ�
C. ����ԭ��ؿ����ṩ�������ȶ��ĵ���
D. ��ԭ��ط�Ӧ�����ӷ���ʽΪ��Cu2++Fe=Cu+Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ:X(s)+Y(g)![]() 2Z(g)���ݻ�Ϊ1L�ܱ�������Ӧ�������������Ƿ�Ӧ�ﵽƽ��״̬�ı�־����
2Z(g)���ݻ�Ϊ1L�ܱ�������Ӧ�������������Ƿ�Ӧ�ﵽƽ��״̬�ı�־����
�ٵ�λʱ��������1molX��ͬʱ����2molZ ��Z������������ٱ仯
����ϵ��ѹǿ���ٸı� ��Y��Z�����ʵ���Ũ�ȱ�Ϊ1:2
��Y��ת���ʲ��ٸı��״̬ ���������ܶȲ��ٸı��״̬
A. ���٢� B. �٢ۢ� C. �٢ܢ� D. �ڢۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��1��������̬����BCl3��CCl4��H2O��BeCl2�У�������ɴ�С��˳��Ϊ ��
��2�����⣨H2S�����ӵĿռ乹��Ϊ��������̼��CO2�����ӵĿռ乹��Ϊ�����飨CH4�����ӵĿռ乹��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���Ӹֹܳ���55137Cs���С�����̽�ˡ��������й�˵����ȷ���ǣ� ��
A.137��ʾ������
B.137��ʾ������
C.��ԭ������������������
D.55��ʾ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I������������Ӧ��
��Ӧ��![]()
![]() =a kJ/molƽ�ⳣ��ΪK1
=a kJ/molƽ�ⳣ��ΪK1
��Ӧ��![]()
![]() ƽ�ⳣ��ΪK2
ƽ�ⳣ��ΪK2
��Ӧ��![]()
![]() =b kJ/molƽ�ⳣ��ΪK3
=b kJ/molƽ�ⳣ��ΪK3
�ڲ�ͬ�¶��£�����K1��K2��ֵ���£�
T/�� | 700 | 800 |
K1 | 2.38 | 2.56 |
K2 | 0.80 |
(1) ![]()
![]() ==____________________
==____________________
(2)K1�ı���ʽΪ____________�����ݷ�Ӧ�����������Ƶ���K1��K2��K3�Ĺ�ϵʽK3=______________��
(3)�ں��º�ѹ�ܱ�������ͨ��CO��H2O��1mol������Ӧ�ڣ�����Ӧ�ﵽƽ���ά���¶���ѹǿ���䣬t1ʱ��ͨ���1mol��CO��H2O�Ļ�����壬������ͼ�л�������v�������棨v������Ӧ������t1����ʱ��t�仯������ͼ_______��
�����ݻ���ͬ�������ܱ�������(װ�е�����ij�ִ���)���ֱ����ͬ����NOx��C3H6���ڲ�ͬ�¶��£�ͬʱ�������·�Ӧ��
18NO(g)+2C3H6(g) 9N2(g)+6CO2(g)+6H2O(g)��
18NO2(g)+4C3H6(g) 9N2(g)+12CO2(g)+12H2O(g)��
���ֱ���t��ʱ�ⶨ����NOxת���ʣ����ͼ������ͼ��ʾ��
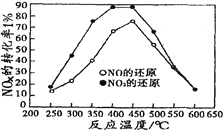
�ٴ�ͼ�п��Եó��Ľ�����
����һ���ӲⶨNOxת���������жϣ���ͬ�¶���NOת��Ч�ʱ�NO2�ĵ͡�
���۶���________________________________________________________
��������NO2��C3H6��Ӧ�У����NO2ת���ʵĴ�ʩ��_____________��(����)
A��������� B�������¶� C.�����H
���³�ѹ�£������е�CO2����ˮ���ﵽƽ��ʱ����Һ��pH=5.6��c(H2CO3)=1.5��10 -5 mol/L��������ˮ�ĵ��뼰H2CO3�ĵڶ������룬��H2CO3HCO3��+ H+ ��ƽ�ⳣ��K1=___________��(��֪��10-5.60=2.5��10-6 )
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��������,���ڿ��淴ӦX(g)+3Y(g)![]() 2Z(g),��X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3(����Ϊ��),�ﵽƽ��ʱ,X��Y��Z��Ũ�ȷֱ�Ϊ0.1 mol��L-1��0.3 mol��L-1��0.08 mol��L-1,�������ж���ȷ����(����)
2Z(g),��X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3(����Ϊ��),�ﵽƽ��ʱ,X��Y��Z��Ũ�ȷֱ�Ϊ0.1 mol��L-1��0.3 mol��L-1��0.08 mol��L-1,�������ж���ȷ����(����)
A. c1��c2=3��1 B. ƽ��ʱ,Y��Z����������֮��Ϊ2��3
C. X��Y��ת���ʲ���� D. c1��ȡֵ��ΧΪ0<c1<0.14 mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
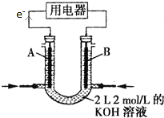
����Ŀ��(1)Ϊ����֤Fe3+��Cu2+������ǿ��������װ���ܴﵽʵ��Ŀ�ĵ���_______��

(2)��CH4��Ƴ�ȼ�ϵ�أ��������ʸ��ߣ�װ����ͼ��ʾ(A��BΪ���̼��)��
A����缫��ӦʽΪ___________��
(3)ijԪ�ص�ͬλ��![]() �������Ȼ���XCl21.11g����ˮ�����Һ����1mo1/L��AgNO3��Һ20mL��ǡ����ȫ��Ӧ��������ͬλ�ص�ԭ�Ӻ�����20�����ӣ�Z��ֵΪ_____��A��ֵΪ______��
�������Ȼ���XCl21.11g����ˮ�����Һ����1mo1/L��AgNO3��Һ20mL��ǡ����ȫ��Ӧ��������ͬλ�ص�ԭ�Ӻ�����20�����ӣ�Z��ֵΪ_____��A��ֵΪ______��
(4)������NH4Br�����ܱ������У���ij�¶��£��������з�Ӧ��
NH4Br(s)![]() NH3(g)+HBr(g) 2HBr(g)
NH3(g)+HBr(g) 2HBr(g)![]() Br2(g)+H2(g)
Br2(g)+H2(g)
2min��֪c(H2)=0.5mo/L��c(HBr)=4mol/L����������Ӧ������v(NH3)��ʾ����v(NH3)=_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ���(SnCl4) ����ýȾ�����л��ϳ��ϵ��Ȼ�������ʵ�����Ʊ����Ȼ�����װ������ͼ(���ּг�װ������ȥ)����֪���ٽ���������ʱͨ�����������Ӧ���������Ȼ������� ��ˮ���Ȼ����۵�-33�����е�114.1�棻����ˮ���Ȼ�����ˮ�������ɰ�ɫ����������˵������ȷ����
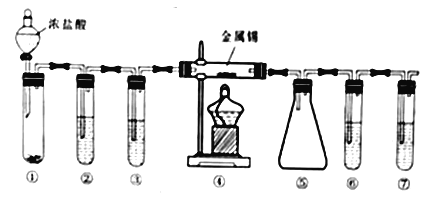
A. ʵ��ʱ�μ�Ũ���ᷴӦһ��ʱ�䣬Ȼ���ٵ�ȼ�ܴ��ľƾ���
B. �������������ߵ��Թ�������ʢװMnO2������ʳ��ˮ��ŨH2SO4��NaOH��Һ
C. ��װ�������ռ�SnCl4����������ˮԡ��Ч������
D. �����������Թܿ�����һ��װ�м�ʯ�ҵĸ����������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com