
【题目】下列实验方法能达到实验目的的是
A.用淀粉溶液检验溶液中是否存在碘单质 B.用分液漏斗分离水与乙醇的混合物
C.用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液 D.用排水集气法收集氯气
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
(1)在 ①液氯 ②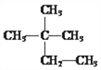 ③白磷 ④氯气
③白磷 ④氯气
⑤![]() ⑥
⑥![]() ⑦
⑦![]() ⑧红磷
⑧红磷
这八种物质中,互为同分异构体的是____,互为同素异形体的是_____。(填序号)
(2)在下列固体中:①CaCl2 ②KOH ③He ④H2SO4 ⑤NH4Cl ⑥金刚石
①其中不含化学键的晶体是_________,
②既含有离子键又含有共价键的物质是______,
③固体熔化时只需破坏共价键的晶体是____(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用ClO2氧化氮氧化物反应过程如下:
NO![]() NO2
NO2![]() 无污染物
无污染物
反应Ⅰ的化学方程式是2NO+ClO2+H2O=NO2+HNO3+HCl,反应Ⅱ的化学方程式是__________________________。
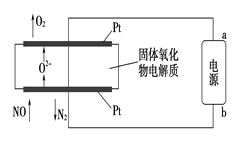
(2)利用固体氧化物电解池通过电解方式分解氮氧化物的过程如图3所示,写出电解池中通入NO一端的电极反应式:_______________________。
(3)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
①则NO2 与SO2反应的热化学方程式为______________________。
②一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_____________。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
e.混合气体的平均分子量不再变化
③测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡时NO2的转化率=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示。下列说法正确的是
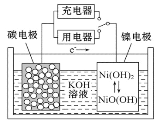
A.充电时,阴极的电极反应为:Ni(OH)2+OH--e-===NiO(OH)+H2O
B.放电时,负极的电极反应为:H2-2e-+2OH-=== 2H2O
C.放电时,OH-移向镍电极
D.充电时,将电池的碳电极与外电源的正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种无色溶液,它们分别是葡萄糖溶液、蔗糖溶液、淀粉溶液、甲酸乙酯中的一种。经实验可知:
(1)B、C均能发生银镜反应。
(2)A遇碘水变蓝色。
(3)A、C、D均能发生水解反应,水解液均能发生银镜反应。试判断它们各是什么物质,并写出有关化学反应方程式:
①A是__________,B是__________,C是____________,D是________。
②有关化学反应方程式:
a.蔗糖水解:__________________________,
b.葡萄糖发生银镜反应:____________________,
c.甲酸乙酯水解:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为硬脂酸甘油酯在碱性条件下水解的装置图,

进行皂化反应时的步骤如下:
(1)在圆底烧瓶中加入7~8 g硬脂酸甘油酯,然后加入2~3 g的氢氧化钠、5 mL水和10 mL酒精,加入酒精的作用是____________________。
(2)隔着石棉网给反应混合物加热约10 min,皂化反应基本完成,所得的混合物为________(填“悬浊液”、“乳浊液”、“溶液”或“胶体”)。
(3)向所得混合物中加入________,静置一段时间后,溶液分为上下两层,肥皂在________层,这个操作称为________。
(4)图中长玻璃导管的作用为__________________________________。
(5)写出该反应的化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,两种氨水A、B,浓度分别是0.2 mol/L和0.1 mol/L,则A和B的OH-浓度之比
A. 大于2 B. 小于2 C. 等于2 D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒和镍及其化合物是重要的催化剂和合金材料。
(1)基态V原子的价层电子排布式为________,其中排布时能量最高的电子所占据能级的原子轨道有________个仲展方向。
(2)VO2+与 可形成配合物。
可形成配合物。 中,三种非金属原子的第一电离能由大到小的顺序为________(用元素符号表示);C原子的杂化轨道类型为_________。
中,三种非金属原子的第一电离能由大到小的顺序为________(用元素符号表示);C原子的杂化轨道类型为_________。
(3)镍形成的[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子中N原子的价层电子对数目为______。与CN-互为等电子体的一种分子的化学式为__________。
(4)La-Ni合金是重要的储氢材料,储氢后的晶胞如图所示。

①合金中,1个La原子周围距离最近且相等的La原子数目为_______。
②含有1mol Ni原子的合金中储存H2的物质的量为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com