
【题目】钒和镍及其化合物是重要的催化剂和合金材料。
(1)基态V原子的价层电子排布式为________,其中排布时能量最高的电子所占据能级的原子轨道有________个仲展方向。
(2)VO2+与 可形成配合物。
可形成配合物。 中,三种非金属原子的第一电离能由大到小的顺序为________(用元素符号表示);C原子的杂化轨道类型为_________。
中,三种非金属原子的第一电离能由大到小的顺序为________(用元素符号表示);C原子的杂化轨道类型为_________。
(3)镍形成的[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子中N原子的价层电子对数目为______。与CN-互为等电子体的一种分子的化学式为__________。
(4)La-Ni合金是重要的储氢材料,储氢后的晶胞如图所示。

①合金中,1个La原子周围距离最近且相等的La原子数目为_______。
②含有1mol Ni原子的合金中储存H2的物质的量为__________。
【答案】 3d34s2 5 O>C>H sp2、sp3 4 N2或CO 6 0.6mol
【解析】(1)V是23号元素,核外有23个电子,基态V原子的电子排布式为1s22s22p63s23p63d34s2,则价层电子排布式为3d34s2;能量最高的为3d轨道,有5个伸展方向;(2)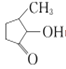 中,三种非金属原子分别为H、C、O,又是同一周期元素,元素的第一电离能随着原子序数的增大而增大,但第ⅱA族、第ⅴA族元素第一电离能大于其他相邻元素,同一主族从上到下,元素的第一电离能逐渐减小,所以H、C、O三种非金属元素原子的第一电离能由大到小的顺序为;又由
中,三种非金属原子分别为H、C、O,又是同一周期元素,元素的第一电离能随着原子序数的增大而增大,但第ⅱA族、第ⅴA族元素第一电离能大于其他相邻元素,同一主族从上到下,元素的第一电离能逐渐减小,所以H、C、O三种非金属元素原子的第一电离能由大到小的顺序为;又由 可以看出C原子分别形成单键和双键,则C原子的杂化轨道类型为sp3和sp2;
可以看出C原子分别形成单键和双键,则C原子的杂化轨道类型为sp3和sp2;
(3)NH3分子中N原子共用电子对数为3对,还有1对孤对电子对,所以NH3分子中N原子的价层电子排布对数目为4对;CN-中含有2个原子,且其价电子数是10,与CN-互为等电子体的一种分子为CO、N2等;
(4)①由晶胞可以看出1个La原子周围距离最近的La原子在顶点上,所以距离最近且相等的La原子数目为6;
②根据晶胞可以看出La原子个数为8×![]() =1,Ni原子个数为8×
=1,Ni原子个数为8×![]() +1=5,所以合金化学式为LaNi5,并且一个晶胞储存2×
+1=5,所以合金化学式为LaNi5,并且一个晶胞储存2×![]() +8×
+8×![]() =3个氢气分子,则1molNi原子的合金中储存H2的物质的量为
=3个氢气分子,则1molNi原子的合金中储存H2的物质的量为![]() mol=0.6mol。
mol=0.6mol。


科目:高中化学 来源: 题型:
【题目】下列实验方法能达到实验目的的是
A.用淀粉溶液检验溶液中是否存在碘单质 B.用分液漏斗分离水与乙醇的混合物
C.用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液 D.用排水集气法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚甲基丙烯酸甲酯的(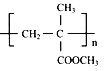 )缩写代号为PMMA。俗称有机玻璃。下列说法中错误的是
)缩写代号为PMMA。俗称有机玻璃。下列说法中错误的是
A. 合成PMMA的单体是甲基丙烯酸和甲醇
B. 聚甲基丙烯酸甲酯的分子式可表示为(C5H8O2)n
C. 聚甲基丙烯酸甲酯属于有机干分子合成材料
D. 甲基丙烯酸甲酯[CH2=C(CH3)COOCH3]中碳原子可能都处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B两种烃,它们的组成相同,都约含85.7%的碳,烃A对氢气的相对密度是28;烃B的式量是烃A的一半,烃A、B都能使溴的四氯化碳溶液褪色,根据以上实验事实回答问题。
(1)推断A、B两烃的分子式:A ;B 。
(2)A、B中(填“A”或“B”)存在同分异构体,同分异构体的名称是 、 、 、 。(有多少写多少)
(3)写出B与溴的四氯化碳溶液反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是( )

A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.2 mol 液态H2O具有的总能量低于2 mol H2和1 mol O2的能量
D.氢气不易贮存和运输,无开发利用价值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到实验目的或者实验操作不正确的是
A. 定容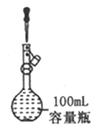
B. 比较硫、碳、硅三种元素
C. 处理尾气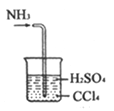
D. 测定黄铜(Cu、Zn素的非金属性强弱合金)中Zn的含量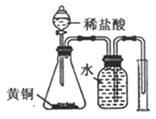
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碱金属和卤素的说法中,错误的是( )。
A.随着核电荷数的增大,碱金属元素和卤素的原子半径都逐渐增大
B.碱金属元素中,锂原子失去电子的能力最弱,卤素中,氟原子得电子能力最强
C.钾与水的反应比钠与水的反应更剧烈
D.溴单质与水反应比氯单质与水反应更剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。

(1)天冬酰胺所含元素中,________(填元素名称,下同)元素基态原子核外未成对电子数最多,第一电离能最大的是________。
(2)天冬酰胺中碳原子的杂化轨道类型为________,分子中σ键和π键数目之比为________。
(3)O、S、Se为同主族元素,H2O、H2S和H2Se的参数对比见表。
化学式 | 键长/nm | 键角 |
H2O | 0.99 | 104.5° |
H2S | 1.34 | 92.3° |
H2Se | 1.47 | 91.0° |
H2S的键角大于H2Se的原因可能为________________________________________。
H2O、H2S、H2Se沸点由高到低的顺序为________________,酸性由强到弱的顺序为________________。
(4)写出铬的基态原子电子排布式:________________________________________。
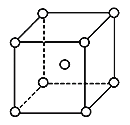
(5)铬为体心立方晶体,晶胞结构如图,则该晶胞中含有______个铬原子。若铬的密度为ρg·cm-3,相对原子质量为M,NA表示阿伏加德罗常数的值,则铬原子的半径为______cm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com