
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用ClO2氧化氮氧化物反应过程如下:
NO![]() NO2
NO2![]() 无污染物
无污染物
反应Ⅰ的化学方程式是2NO+ClO2+H2O=NO2+HNO3+HCl,反应Ⅱ的化学方程式是__________________________。
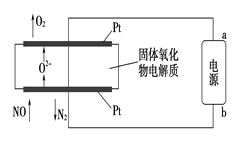
(2)利用固体氧化物电解池通过电解方式分解氮氧化物的过程如图3所示,写出电解池中通入NO一端的电极反应式:_______________________。
(3)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
①则NO2 与SO2反应的热化学方程式为______________________。
②一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_____________。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
e.混合气体的平均分子量不再变化
③测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡时NO2的转化率=____________。
【答案】(1)2NO2+4Na2SO3===N2+4Na2SO4
(2)2NO+4e-===N2+2O2-
(3)①NO2(g)+SO2(g)![]() SO3(g) + NO(g) ΔH=-41.8 kJ·mol-1 ② b ③80%
SO3(g) + NO(g) ΔH=-41.8 kJ·mol-1 ② b ③80%
【解析】
试题分析:(1)反应Ⅱ为NO2和Na2SO3反应生成N2和Na2SO4,反应的化学方程式为2NO2+4Na2SO3===N2+4Na2SO4;(2)电解池的阴极上,NO发生得电子的还原反应生成N2,因此电极反应式为:2NO+4e-===N2+2O2-;阳极上,O2-发生失去电子的氧化反应,生成O2,电极反应式为:2 O2--4e-===O2;(3)①根据盖斯定律,可以写出NO2 与SO2反应的热化学方程式为NO2+SO2(g) ![]() SO3(g) + NO(g) ΔH=-41.8 kJ·mol-1;②判断可逆反应达到平衡状态的依据有:第一,各物质的浓度保持不变;第二,正逆反应速率相等。a.由于该反应是气体分子数不变的反应,因此恒容条件下,体系的压强始终不变,故a错误;b. NO2是红棕色气体,而其他气体均为无色,因此当混合气体的颜色不变时,能够证明反应达到平衡状态,b正确;c. SO3和NO的体积比保持不变,不能证明达到平衡状态,c错误;d. 每消耗1 mol SO3的同时生成1 mol NO2,都表示逆反应速率,d错误;e.混合气体的平均分子量为
SO3(g) + NO(g) ΔH=-41.8 kJ·mol-1;②判断可逆反应达到平衡状态的依据有:第一,各物质的浓度保持不变;第二,正逆反应速率相等。a.由于该反应是气体分子数不变的反应,因此恒容条件下,体系的压强始终不变,故a错误;b. NO2是红棕色气体,而其他气体均为无色,因此当混合气体的颜色不变时,能够证明反应达到平衡状态,b正确;c. SO3和NO的体积比保持不变,不能证明达到平衡状态,c错误;d. 每消耗1 mol SO3的同时生成1 mol NO2,都表示逆反应速率,d错误;e.混合气体的平均分子量为![]() ,由于该反应的整个过程中,气体的总质量与气体的总物质的量均不变,因此混合气体的平均分子量始终不变,e错误。故答案b。③假设NO2与SO2的初始物质的量分别为1mol和2mol,转化量为a mol,则:
,由于该反应的整个过程中,气体的总质量与气体的总物质的量均不变,因此混合气体的平均分子量始终不变,e错误。故答案b。③假设NO2与SO2的初始物质的量分别为1mol和2mol,转化量为a mol,则:
NO2(g)+SO2(g) ![]() SO3(g) + NO(g)
SO3(g) + NO(g)
初始(mol) 1 2 0 0
转化(mol) a a a a
平衡(mol) 1-a 2-a a a
测得上述反应平衡时NO2与SO2体积比为1∶6,则根据理想气体状态方程可知,同温同压下,气体的体积之比等于物质的量之比,故![]() ,解得,
,解得,![]() ,故NO2的转化率为80%。
,故NO2的转化率为80%。


科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图,有下列说法:
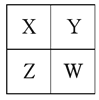
若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
若四种元素均为非金属,则W的最高价氧化物对应的水化物一定为强酸
④若四种元素只有一定为金属,则Z与Y的最高价氧化物对应的水化物一定为强酸。
其中不正确的说法有几项
A. 1项 B. 2项 C. 3项 D. 4项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质或微粒的化学用语或模型正确的是
A. 中子数为8的碳原子: ![]() B. S2-的结构示意图:
B. S2-的结构示意图: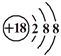
C. 二氧化碳电子式:![]() D. 氮气的结构式:N-N
D. 氮气的结构式:N-N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与NaOH溶液反应)中 AlN的含量,某实验小组设计了如下两种实验方案。已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
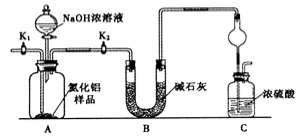
(1)上图C装置中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,首先检查装置的气密性,再加入实验药品。接下来的实验操作是 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是 。
(3)由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见 。
【方案2】按以下步骤测定样品中A1N的纯度:
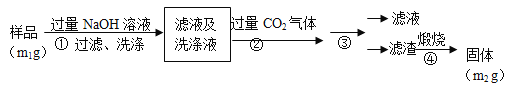
(4)步骤②生成沉淀的离子方程式为_________________。
(5)步骤③的操作是 。A1N的纯度是 (用m1、m2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物X含有2种元素,是农业生产的一种杀虫剂,具有以下一系列变化:
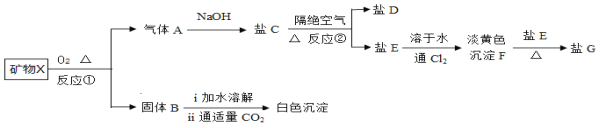
已知:1、气体A是形成酸雨的主要物质之一;
2、固体B是一种重要的建筑材料;
3、8.4gX在O2中充分灼烧得到2.8g固体B;
4、盐G的结构和Na2O2类似
请回答以下问题:
(1)写出CO2的电子式 ;X的化学式是 ;
(2)写出NaOH溶液中通入过量气体A的离子反应方程式 ;
(3)写出②的化学反应方程式 ;
(4)盐C在空气中易变质,请设计实验检验盐C是否变质 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有易溶强电解质的混合溶液10L,其中可能含有K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如下明所示,下列说法正确的是

A. 该溶液中能确定存在的离子是Ba2+、AlO2-、NH4+
B. 肯定不存在的离子是SO42-、OH-
C. 若不能确定的离子中至少还存在着一种阳离子,则该离子的最小浓度为0.2 mol/L
D. OA段反应的离子方程式:2 AlO2-+ CO2+3H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法能达到实验目的的是
A.用淀粉溶液检验溶液中是否存在碘单质 B.用分液漏斗分离水与乙醇的混合物
C.用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液 D.用排水集气法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚甲基丙烯酸甲酯的(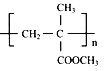 )缩写代号为PMMA。俗称有机玻璃。下列说法中错误的是
)缩写代号为PMMA。俗称有机玻璃。下列说法中错误的是
A. 合成PMMA的单体是甲基丙烯酸和甲醇
B. 聚甲基丙烯酸甲酯的分子式可表示为(C5H8O2)n
C. 聚甲基丙烯酸甲酯属于有机干分子合成材料
D. 甲基丙烯酸甲酯[CH2=C(CH3)COOCH3]中碳原子可能都处于同一平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com