
【题目】在2L密闭容器中发生反应A(g)+3B(g)![]() 2C(g),30s内C的物质的量增加了0.6mol,下列关于速率表示正确的是( )
2C(g),30s内C的物质的量增加了0.6mol,下列关于速率表示正确的是( )
A. v(A)=0.005mol·L-1·s-1B. v(C)=0.002 mol·L-1·s-1
C. v(B)=0.003 mol·L-1·s-1D. v(A)=0.001mol·L-1·s-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2OH++OH-△H>0,下列叙述正确的是( )
A. 向平衡体系中加入水,平衡正向移动,c (H+)增大
B. 将水加热,Kw增大,pH不变
C. 向水中加入少量硫酸氢钠固体, 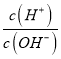 增大
增大
D. 向水中加入少量NaOH固体,平衡正向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应2Na+2H2O=2NaOH+H2↑的说法错误的是( )
A.属于氧化还原反应
B.金属钠发生还原反应
C.水发生还原反应
D.H2是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过如下流程制备氧化亚铜:
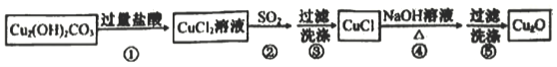
已知CuCl难溶于水和稀硫酸:Cu2O+2H+==Cu2++Cu+H2O
下列说法不正确的是
A. 步骤②SO2可用Na2SO3替换
B. 步骤③中为防止CuCl被氧化,可用SO2水溶液洗涤
C. 步骤④发生反应的离子方程式为2CuCl+2OH-=Cu2O+2Cl-+H2O
D. 如果Cu2O试样中混有CuCl和CuO杂质,用足量稀硫酸与Cu2O试样充分反应,根据反应前、后固体质量可计算试样纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可以由N2和H2合成NH3,已知该反应为放热反应。
(1)写出该反应的化学方程式______________。已知:1molN2的共价键断裂吸收的能量为Q1kJ;1molH2的化学键断裂吸收的能量为Q2kJ;形成1molNH3中的化学键释放的能量为Q3kJ。则Q1+3Q2_____2Q3(填“>”、“<”或“=”)。
(2)写出加快合成氨反应速率的措施_______________。
(3)工业上也可通过电解的方法由N2制取NH3:2N2 +6H2O![]() 4NH3 +3O2,若制得8.96L(标准状况下)NH3,转移电子_____mol。
4NH3 +3O2,若制得8.96L(标准状况下)NH3,转移电子_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:
①此配合物中,铁离子价电子排布图为_____;
②此配离子中碳原子的杂化轨道类型为_____;
③此配离子中含有的化学键为_____。
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G.σ键 H.π键
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子的VSEPR模型名称为_____,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是_____。
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2,其中适合作录音带磁粉原料的是_____。

(4)锰的一种配合物的化学式为Mn(BH4)2(THF)3,写出两种与BH4-互为等电子体的微粒_____(请写一个分子和一个离子)。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为_____,已知晶胞密度为ρ g/cm3,则相邻2个b微粒之间的距离为_____nm(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( )
A. 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B. 向氨水中加入浓氢氧化钠溶液,加热产生使湿润的红色石蕊试纸变蓝的气体,说明氨水中含有NH4+
C. 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3具有热不稳定性
D. 将红热的Pt丝伸入如图所示的锥形瓶中,瓶口出现少量的红棕色气体,说明氨气催化氧化的产物中有NO
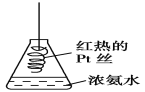
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是采用新能源储能器件将CO2转化为固体产物,实现CO2的固定和储能灵活应用的装置。储能器件使用Li-CO2电池,组成为:钌电极/CO2饱和的LiClO4-DMSO电解液/锂片。下列说法不正确的是
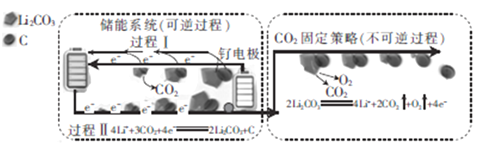
A. Li-CO2电池的电解液由LiClO4和DMSO溶于水得到
B. CO2的固定中,每转移8 mol e-,生成6 mol气体
C. 过程Ⅱ中化学能转化为电能
D. 过程Ⅰ的钌电极的电极反应式为2Li2CO3+C-4e-═4Li++3CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com