
【题目】2005年诺贝尔化学奖授予了研究烯烃复分解反应的科学家,以表彰他们作出的卓越贡献。烯烃复分解反应原理如下:C2H5CH=CHCH3 + CH2=CH2 ![]() C2H5CH=CH2 + CH2=CHCH3,现以烯烃C5H10为原料,合成有机物M和N,合成路线如下:
C2H5CH=CH2 + CH2=CHCH3,现以烯烃C5H10为原料,合成有机物M和N,合成路线如下:

(1)按系统命名法,有机物A的名称是___________。
(2)B的结构简式是___________。
(3)C![]() D的反应类型是___________。
D的反应类型是___________。
(4)写出D![]() M的化学方程式___________。
M的化学方程式___________。
(5)写出E![]() F合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
F合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
(6)已知X的苯环上只有一个取代基,且取代基无甲基,则N的结构简式为___________。
(7)满足下列条件的X的同分异构体共有___________种,写出任意一种的结构简式___________。
①遇FeCl3溶液显紫色 ②苯环上的一氯取代物只有两种
【答案】 2-甲基-1-丁烯 CH3CH2C(CH3)=C(CH3)CH2CH3 取代(水解)反应  CH3CH2CBr(CH3)CH2Br
CH3CH2CBr(CH3)CH2Br![]() CH3CH2COH(CH3)CH2OH
CH3CH2COH(CH3)CH2OH![]() CH3CH2COH(CH3)CHO
CH3CH2COH(CH3)CHO![]()

 3
3 


【解析】(1)由F的结构可以判断A的结构简式为:CH2=C(CH3) CH2-CH3,根据系统命名法命名为2-甲基-1-丁烯,故答案为:2-甲基-1-丁烯。
(2)根据题干中给的烯烃复分解反应原理:C2H5CH=CHCH3 + CH2=CH2 ![]() C2H5CH=CH2 + CH2=CHCH3,推测出两个A之间发生复分解后的产物为CH3CH2C(CH3)=C(CH3)CH2CH3和CH2= CH2,故答案为:CH3CH2C(CH3)=C(CH3)CH2CH3。
C2H5CH=CH2 + CH2=CHCH3,推测出两个A之间发生复分解后的产物为CH3CH2C(CH3)=C(CH3)CH2CH3和CH2= CH2,故答案为:CH3CH2C(CH3)=C(CH3)CH2CH3。
(3)B与Br2发生加成反应生成C,c的结构简式为:CH3CH2CBr(CH3)CBr(CH3)CH2CH3,C在碱性条件下水解生成D。水中羟基取代溴得位置,所以发生了取代反应,故答案为:取代(水解)反应。
(4)D![]() M是
M是 与HOOC-COOH发生酯化反应生成环酯,反应的方程式为:
与HOOC-COOH发生酯化反应生成环酯,反应的方程式为: 。
。
(5)E![]() F是E中的Br被-OH取代,同时一个羟基被催化氧化最终变成羧基的过程,合成路线为:CH3CH2CBr(CH3)CH2Br
F是E中的Br被-OH取代,同时一个羟基被催化氧化最终变成羧基的过程,合成路线为:CH3CH2CBr(CH3)CH2Br![]() CH3CH2COH(CH3)CH2OH
CH3CH2COH(CH3)CH2OH![]() CH3CH2COH(CH3)CHO
CH3CH2COH(CH3)CHO![]()
 。
。
(6)G只有一个甲基说明G的结构简式为: ,G的分子式是C5H8O2与X反应后生成C13H16O2,发生了酯化反应并且增加了8个C,8个H,根据酯化反应酸脱羟基醇脱氢可知X的分子式为C8H9O,且X中只有一个取代基没有甲基,可知X为苯乙醇,因此推出N的结构简式为:
,G的分子式是C5H8O2与X反应后生成C13H16O2,发生了酯化反应并且增加了8个C,8个H,根据酯化反应酸脱羟基醇脱氢可知X的分子式为C8H9O,且X中只有一个取代基没有甲基,可知X为苯乙醇,因此推出N的结构简式为: 。
。
(7)符合两个条件的结构中包含了一个酚羟基,同时具有对称结构,所以符合条件的结构有
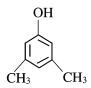
 共3种,故答案为:3;
共3种,故答案为:3;

 其中一种。
其中一种。


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】工业上用含三价钒(V2O3)为主的某石煤为原料(含有Al2O3、CaO等杂质),钙化法焙烧制备V2O5,其流程如下:
![]()
【资料】:+5价钒在溶液中的主要存在形式与溶液pH的关系:
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 | VO2+ | VO3 | V2O74 | VO43 |
(1)焙烧:向石煤中加生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式是______。
(2)酸浸: ① Ca(VO3)2难溶于水,可溶于盐酸。若焙砂酸浸时溶液的pH=4,Ca(VO3)2溶于盐酸的离子方程式是______。
② 酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约3.2%,根据如图推测,酸浸时不选择更高酸度的原因是______。

(3)转沉:将浸出液中的钒转化为NH4VO3固体,其流程如下:
![]()
① 浸出液中加入石灰乳的作用是______。
② 已知CaCO3的溶解度小于Ca3(VO4)2。向Ca3(VO4)2沉淀中加入(NH4)2CO3溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:______。
③ 向(NH4)3VO4溶液中加入NH4Cl溶液,控制溶液的pH=7.5。当pH>8时,NH4VO3的产量明显降低,原因是______。
(4)测定产品中V2O5的纯度:
称取a g产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1 mL c1 mol·L1 (NH4)2Fe(SO4)2溶液(VO2+ + 2H+ + Fe2+ == VO2+ + Fe3+ + H2O)。最后用c2 mol·L1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2 mL。已知 MnO4被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是______。(V2O5的摩尔质量:182 g·mol1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于组成生物体的元素和化合物的叙述,正确的是
A. 磷是构成脂肪、ATP、核酸等不可缺少的成分,是组成生物体的大量元素
B. RNA通常只有一条链,它的碱基组成与DNA完全不同
C. 干种子内结合水的含量相对较低,不能进行旺盛的生命活动
D. 若甲硫氨酸的R基是-CH2-CH2-S-CH3,则它的分子式是C5H11O2NS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:相关反应的热化学方程式如下:
CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) ΔH1=-175.6 kJ·mol1(反应Ⅰ)
CaS(s)+4CO2(g) ΔH1=-175.6 kJ·mol1(反应Ⅰ)
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) ΔH2=+218.4 kJ·mol1(反应Ⅱ)
CaO(s)+SO2(g)+CO2(g) ΔH2=+218.4 kJ·mol1(反应Ⅱ)
假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同分异构现象是造成有机物种类繁多的重要原因之一。下列互为同分异构体的是
A.甲烷与丙烷B.乙醇与乙酸
C.乙烯与乙烷D.CH3CH2CH2CH3与CH3CH(CH3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢气体在资源利用和环境保护等方面均有重要应用。
(1)工业采用高温分解H2S制取氢气,2H2S(g) ![]() 2H2(g) + S2(g),在膜反应器中分离出H2。在容积为 2L 的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为 1mol,实验过程中测得H2S的转化率如图所示。曲线 a 表示H2S的平衡转化率与温度的关系,曲线 b 表示不同温度下反应经过相同时间时H2S的转化率。
2H2(g) + S2(g),在膜反应器中分离出H2。在容积为 2L 的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为 1mol,实验过程中测得H2S的转化率如图所示。曲线 a 表示H2S的平衡转化率与温度的关系,曲线 b 表示不同温度下反应经过相同时间时H2S的转化率。

①反应2H2S(g) ![]() 2H2(g) + S2(g)的ΔH_________(填“>”“<”或“=”)0。
2H2(g) + S2(g)的ΔH_________(填“>”“<”或“=”)0。
②985℃时,反应经过5 s达到平衡状态,此时H2S的转化率为40%,则用H2表示的反应速率为v(H2) =___________。
③随着H2S分解温度的升高,曲线b向曲线a逐渐靠近,其原因是___________。
(2)将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如下图所示。
①在图示的转化中,化合价不变的元素是____________。
②在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有____________。


(3)工业上常采用上图电解装置电解K4[Fe(CN)6]和KHCO3混合溶液,电解一段时间后,通入H2S 加以处理。利用生成的铁的化合物K3[Fe(CN)6]将气态废弃物中的H2S 转化为可利用的S,自身转化为K4[Fe(CN)6]。
①电解时,阳极的电极反应式为___________。
②当有16 g S析出时,阴极产生的气体在标准状况下的体积为___________。
③通入H2S 时发生如下反应,补全离子方程式:_________________
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系不正确的是( )
A. 0.1 mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B. 1 L浓度均为 0.1 mol·L-1 CuSO4、(NH4)2SO4的混合溶液中:c(SO![]() )>c(NH)>c(Cu2+)>c(H+)>c(OH-)
)>c(NH)>c(Cu2+)>c(H+)>c(OH-)
C. 0.1 mol·L-1 NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO![]() )+c(OH-)
)+c(OH-)
D. 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中的反应:3H2(g) + N2(g) ![]() 2NH3(g) △H<0,正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是
2NH3(g) △H<0,正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是

A. 其他条件不变,增大NH3浓度的同时减小N2浓度
B. 其他条件不变,再充入N2和H2
C. 其他条件不变,扩大容器的体积
D. 其他条件不变,降低反应温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水钴矿中除SiO2外,还有9.24%CoO、2.78%Fe2O3、0.96%MgO、0.084%CaO。


(1)在一定浓度的![]() 溶液中,钴的浸出率随时间、温度的变化如图1所示
溶液中,钴的浸出率随时间、温度的变化如图1所示![]() 考虑生产成本和效率,最佳的浸出时间为______小时,最佳的浸出温度为______
考虑生产成本和效率,最佳的浸出时间为______小时,最佳的浸出温度为______![]()
(2)请配平下列除铁的化学方程式:____________
_ _Fe2(SO4)3+ H2O + Na2CO3 == Na2Fe6(SO4)4(OH)12↓+ Na2SO4 + CO2↑
(3) “除钙、镁”的原理反应为:![]() ;
;![]() 已知
已知![]() ,加入过量NaF溶液反应完全后过滤,则滤液中
,加入过量NaF溶液反应完全后过滤,则滤液中![]() ____________________.
____________________.
(4) “沉淀”中含杂质离子主要有![]() 、
、![]() 、_________和__________;“操作X”包括_________和_________。
、_________和__________;“操作X”包括_________和_________。
(5)某锂离子电池正极是![]() ,含
,含![]() 导电固体为电解质
导电固体为电解质![]() 充电时,
充电时,![]() 还原为Li,并以原子形式嵌入电池负极材料碳
还原为Li,并以原子形式嵌入电池负极材料碳![]() 中
中![]() 如图2所示
如图2所示![]() 电池反应为
电池反应为![]()
![]()
![]() ,写出该电池放电时的正极反应式 ________________________________________.
,写出该电池放电时的正极反应式 ________________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com