
【题目】水钴矿中除SiO2外,还有9.24%CoO、2.78%Fe2O3、0.96%MgO、0.084%CaO。


(1)在一定浓度的![]() 溶液中,钴的浸出率随时间、温度的变化如图1所示
溶液中,钴的浸出率随时间、温度的变化如图1所示![]() 考虑生产成本和效率,最佳的浸出时间为______小时,最佳的浸出温度为______
考虑生产成本和效率,最佳的浸出时间为______小时,最佳的浸出温度为______![]()
(2)请配平下列除铁的化学方程式:____________
_ _Fe2(SO4)3+ H2O + Na2CO3 == Na2Fe6(SO4)4(OH)12↓+ Na2SO4 + CO2↑
(3) “除钙、镁”的原理反应为:![]() ;
;![]() 已知
已知![]() ,加入过量NaF溶液反应完全后过滤,则滤液中
,加入过量NaF溶液反应完全后过滤,则滤液中![]() ____________________.
____________________.
(4) “沉淀”中含杂质离子主要有![]() 、
、![]() 、_________和__________;“操作X”包括_________和_________。
、_________和__________;“操作X”包括_________和_________。
(5)某锂离子电池正极是![]() ,含
,含![]() 导电固体为电解质
导电固体为电解质![]() 充电时,
充电时,![]() 还原为Li,并以原子形式嵌入电池负极材料碳
还原为Li,并以原子形式嵌入电池负极材料碳![]() 中
中![]() 如图2所示
如图2所示![]() 电池反应为
电池反应为![]()
![]()
![]() ,写出该电池放电时的正极反应式 ________________________________________.
,写出该电池放电时的正极反应式 ________________________________________.
【答案】 12 90 ![]()
![]() =1.5
=1.5 ![]()
![]() 洗涤 干燥
洗涤 干燥 ![]()
【解析】根据流程图,浸出时间越长浸出率越高,温度越高,浸出率越高,但浸出12h后,浸出率变化不大,90℃和120℃浸出率相差不大,且时间过长,温度过高导致成本较大,所以最佳的浸出时间为12h,最佳的浸出温度为90℃。
(2)除铁反应为非氧化还原反应,根据原子守恒配平方程式,所以其方程式为:3Fe2(SO4)3+6H2O +6Na2CO3 ==Na2Fe6(SO4)4(OH)12↓+5Na2SO4 +6 CO2↑,因此,本题答案为:![]()
(3)由Ksp(CaF2)=c(Ca2+)![]() c2(F-)=1.11
c2(F-)=1.11![]() 10-10,Ksp(MgF2)= c(Mg2+)
10-10,Ksp(MgF2)= c(Mg2+)![]() c2(F-)=7.40
c2(F-)=7.40![]() 10-11
10-11
![]() =
=![]() =1.5
=1.5
(4)流程中加入的Na+、![]() 、
、![]() 、NH4+ 未除去,因此 “沉淀”中含杂质离子主要有
、NH4+ 未除去,因此 “沉淀”中含杂质离子主要有![]() 、
、![]() 、
、![]() 、
、![]() ;对过滤后的沉淀进行洗涤、干燥后能得到草酸钴晶体。因此本题正确答案为:
;对过滤后的沉淀进行洗涤、干燥后能得到草酸钴晶体。因此本题正确答案为: ![]() ;
;![]() ;洗涤 ;干燥。
;洗涤 ;干燥。
(5)放电时,该电池是原电池,原电池正极发生还原反应,反应式为:CoO2+Li++e-=LiCoO2 。


科目:高中化学 来源: 题型:
【题目】2005年诺贝尔化学奖授予了研究烯烃复分解反应的科学家,以表彰他们作出的卓越贡献。烯烃复分解反应原理如下:C2H5CH=CHCH3 + CH2=CH2 ![]() C2H5CH=CH2 + CH2=CHCH3,现以烯烃C5H10为原料,合成有机物M和N,合成路线如下:
C2H5CH=CH2 + CH2=CHCH3,现以烯烃C5H10为原料,合成有机物M和N,合成路线如下:

(1)按系统命名法,有机物A的名称是___________。
(2)B的结构简式是___________。
(3)C![]() D的反应类型是___________。
D的反应类型是___________。
(4)写出D![]() M的化学方程式___________。
M的化学方程式___________。
(5)写出E![]() F合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
F合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
(6)已知X的苯环上只有一个取代基,且取代基无甲基,则N的结构简式为___________。
(7)满足下列条件的X的同分异构体共有___________种,写出任意一种的结构简式___________。
①遇FeCl3溶液显紫色 ②苯环上的一氯取代物只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的KOH溶液时,导致浓度偏低的原因可能是( )
A. 用敞口容器称量KOH且时间过长
B. 配置前先向容量瓶中加入少量蒸馏水
C. 容量瓶盛过KOH溶液,使用前未洗涤
D. 溶解后快速转移到容量瓶,然后加足量蒸馏水,定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作或判断正确的有![]()
①用10mL量筒准确量取稀硫酸溶液![]() ;
;
②用干燥的pH试纸测定氯水的pH;
③能说明亚硝酸是弱电解质的是:用![]() 溶液作导电试验,灯泡很暗;
溶液作导电试验,灯泡很暗;
④使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大;
⑤将饱和![]() 溶液滴入蒸馏水中即得
溶液滴入蒸馏水中即得![]() 胶体;
胶体;
⑥圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上;
⑦除去铁粉中混有的少量铝粉![]() 可加入过量的氢氧化钠溶液,完全反应后过滤;
可加入过量的氢氧化钠溶液,完全反应后过滤;
⑧为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量;
⑨用食醋除去水壶中的水垢.
A. 3个 B. 4个 C. 5个 D. 6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为前四周期原子序数依次增大的六种元素,A、C、D原子均有两个未成对电子,A、B、C同周期,A与D、B与F分别同主族,E是生活中用量最大的金属。请回答下列问题:
(1)E比较稳定的离子核外电子排布式_____________________________.
(2)A、B、C的第一电离能由小到大的顺序为_________________![]() 用元素符号表示
用元素符号表示![]() 、B、C的简单氢化物中最易汽化的物质的化学式___________.
、B、C的简单氢化物中最易汽化的物质的化学式___________.
(3)C与D形成的物质的晶体类型是____________,IT产业中该晶体用于生产____________.
(4)由A、B、C三种元素中的一种或两种元素形成的分子中,有的互为等电子体,写出其中一组等电子体的化学式:______![]() 并写出对应的结构式_______________.
并写出对应的结构式_______________.
(5)B的单质晶胞与![]() 的相似,则一个晶胞中含B的原子个数为____
的相似,则一个晶胞中含B的原子个数为____![]() 与氢形成的分子空间构型是_______.
与氢形成的分子空间构型是_______.
(6)“砒霜”是一种含C,F的化合物,其分子结构如图1所示,该化合物的分子式为F4C6,F原子采取______杂化;C,D,E组成的化合物的晶胞如图2,其晶胞参数为a pm,则其密度为___________________g/cm3(列出式子即可,阿伏伽德罗常数为NAmol-1)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NH4Cl浓度小于0.1 mol/L时,溶液pH > 5.1现用0.1 mol/L HCl溶液来滴定10 mL 0.05 mol/L氨水,用甲基橙作指示剂,达到终点时所用盐酸的体积( )
A. = 10 mL B. = 5 mL C. > 5 mL D. < 5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 羰基庚酸是一种重要的化工中间体,下面合成它的流程图:
羰基庚酸是一种重要的化工中间体,下面合成它的流程图:
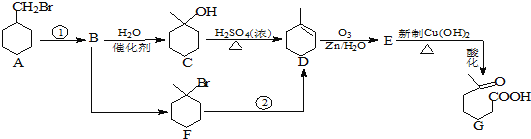
已知:![]()
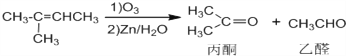
![]()
回答下列问题:
(1)反应![]() 的条件是 _______________ ;1mol化合物C完全燃烧需要消耗O2 ___________ mol
的条件是 _______________ ;1mol化合物C完全燃烧需要消耗O2 ___________ mol
(2)G所含的官能团的名称是 _____________________ ;
(3)下列说法中正确的是 ______________ :
![]() 与足量的Na反应生成
与足量的Na反应生成![]()
![]() 能被催化氧化成酮
能被催化氧化成酮
![]() 在Ni催化下1molG最多只能与
在Ni催化下1molG最多只能与![]() 加成
加成 ![]() 能发生消去反应生成两种不同烯烃
能发生消去反应生成两种不同烯烃
(4)E与新制![]() 的化学方程式为 _________________。
的化学方程式为 _________________。
(5)G的同分异构体有多种,请写出符合下列要求的同分异构体:___________________________________________________
①结构中含有 ②属于酯类 ③能发生银镜反应
②属于酯类 ③能发生银镜反应
(6)写出以 为原料制备
为原料制备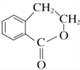 的合成路线流程图
的合成路线流程图![]() 无机试剂任用
无机试剂任用![]() ,并注明反应条件。_________________
,并注明反应条件。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)福州大学王新晨教授以氨基氰(CH2N2)为原料制得类石墨相氮化碳(g-C3N4),其单层结构如图1。

①氨基氰CH2N2)分子中C、N原子均满足8电子稳定结构,则该分子的结构式为______;该分子为______(填“极性”或“非极性”)分子。
②氨基氰易溶于水或乙醇,其主要原因是_____________。
③关于g- C3N4的叙述正确的是_________。
A.电负性:C>N B.该物质的熔点比石墨更高
C.该物质属于原子晶体 D.该物质中C和N原子均采取SP2杂化
(2)NH3与Zn2+可形成[Zn(NH3)6]2+离子,部分结构如图2。

①NH3的空间构型为_________。
②[Zn(NH3)6]2+离子中存在的化学键类型有______;NH3分子中H-N-H键角为107.3°,判断[Zn(NH3)6]2+离子中H-N-H键角______107.3°(填">”、"<”或“=”)。
③肼(N2H4)可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。与N2H4互为等电子体的分子有_______。(写一种)
(3)N元素形成的简单离子N3-与Xn+形成的晶体的是立方体结构,边长为anm,如图3所示。

①Xn+中所有的电子恰好充满K、L、M三个电子层,则基态X原子的价电子的轨道表示式为________。
②已知该晶体的密度为5.84g·cm-3,则阿伏加德罗常数NA的计算表示式为_____(含a)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。磷的化合物在药物生产和农药制造等方面用途非常广泛。请回答下列有关问题:
(1)画出基态P原子的核外电子排布图__________。
(2)NH3比PH3易液化的原因是_________。
(3)P4S3可用于制造火柴,其结构如图1所示。
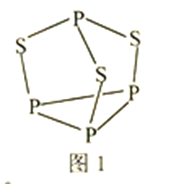
①P4S3中硫原子的杂化轨道类型为________。
②电负性:磷_____硫(填“>”或“<”);第一电离能磷大于硫的原因是________。
(4)NH4BF4是合成氮化硼纳米管的原料之一,1molNH4BF4中含有____mol配位键。
(5)NF3的键角小于NH3的键角,其原因是____________。
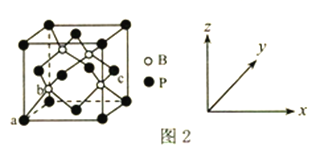
(6)磷化硼是一种超硬耐磨涂层材料,其晶胞结构如图2所示。原子坐标参数表示晶胞内部各原子的相对位置,图中a点和c点的原子坐标参数依次为(0,0,0)、(1,![]() ,
,![]() ),则b点的原子坐标参数为________;已知该晶胞中距离最近的两个磷原子的核间距离为Lpm,则该晶体密度为_____g.cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
),则b点的原子坐标参数为________;已知该晶胞中距离最近的两个磷原子的核间距离为Lpm,则该晶体密度为_____g.cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com