
【题目】(1)福州大学王新晨教授以氨基氰(CH2N2)为原料制得类石墨相氮化碳(g-C3N4),其单层结构如图1。

①氨基氰CH2N2)分子中C、N原子均满足8电子稳定结构,则该分子的结构式为______;该分子为______(填“极性”或“非极性”)分子。
②氨基氰易溶于水或乙醇,其主要原因是_____________。
③关于g- C3N4的叙述正确的是_________。
A.电负性:C>N B.该物质的熔点比石墨更高
C.该物质属于原子晶体 D.该物质中C和N原子均采取SP2杂化
(2)NH3与Zn2+可形成[Zn(NH3)6]2+离子,部分结构如图2。

①NH3的空间构型为_________。
②[Zn(NH3)6]2+离子中存在的化学键类型有______;NH3分子中H-N-H键角为107.3°,判断[Zn(NH3)6]2+离子中H-N-H键角______107.3°(填">”、"<”或“=”)。
③肼(N2H4)可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。与N2H4互为等电子体的分子有_______。(写一种)
(3)N元素形成的简单离子N3-与Xn+形成的晶体的是立方体结构,边长为anm,如图3所示。

①Xn+中所有的电子恰好充满K、L、M三个电子层,则基态X原子的价电子的轨道表示式为________。
②已知该晶体的密度为5.84g·cm-3,则阿伏加德罗常数NA的计算表示式为_____(含a)。
【答案】 ![]() 极性 ②氨基氰分子与水或乙醉分子间易形成氢键 BD 三角锥形 配位键、共价键 > CH3OH或CH3SH等
极性 ②氨基氰分子与水或乙醉分子间易形成氢键 BD 三角锥形 配位键、共价键 > CH3OH或CH3SH等 ![]()
![]() 或
或![]()
【解析】(1)①氨基氰CH2N2)分子中C、N原子均满足8电子稳定结构,该分子的结构式为![]() ;为极性分子;②氨基氰分子与水或乙醇分子间易形成氢键,故氨基氰易溶于水或乙醇;③A.非金属性越强元素的电负性越强,则电负性: N > C,选项A错误;B.碳氮键键长短于碳碳键,形成共价键的键能越高,故g- C3N4的熔点比石墨更高,选项B正确;C.该物质属于分子晶体,选项C错误; D.该物质中C、N原子两两相连且成环,C和N原子均采取SP2杂化,选项D正确。答案选BD;(2)①NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,分子空间构型是三角锥形;②[Zn(NH3)6]2+离子中存在的化学键类型有配位键、共价键;受配位键的影响, [Zn(NH3)6]2+离子中H-N-H键角>107.3°;③等电子体是指原子数相同、价电子数相同、具有相似结构的分子、离子、或离子团。与N2H4互为等电子体的分子有CH3OH或CH3SH等;(3)①Xn+中所有的电子恰好充满K、L、M三个电子层,则基态X原子的核外电子排布式为1s22s22p63s23p63d104s2,其价电子的轨道表示式为
;为极性分子;②氨基氰分子与水或乙醇分子间易形成氢键,故氨基氰易溶于水或乙醇;③A.非金属性越强元素的电负性越强,则电负性: N > C,选项A错误;B.碳氮键键长短于碳碳键,形成共价键的键能越高,故g- C3N4的熔点比石墨更高,选项B正确;C.该物质属于分子晶体,选项C错误; D.该物质中C、N原子两两相连且成环,C和N原子均采取SP2杂化,选项D正确。答案选BD;(2)①NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,分子空间构型是三角锥形;②[Zn(NH3)6]2+离子中存在的化学键类型有配位键、共价键;受配位键的影响, [Zn(NH3)6]2+离子中H-N-H键角>107.3°;③等电子体是指原子数相同、价电子数相同、具有相似结构的分子、离子、或离子团。与N2H4互为等电子体的分子有CH3OH或CH3SH等;(3)①Xn+中所有的电子恰好充满K、L、M三个电子层,则基态X原子的核外电子排布式为1s22s22p63s23p63d104s2,其价电子的轨道表示式为![]() ;②根据图3知,每个晶胞中含有N3-8
;②根据图3知,每个晶胞中含有N3-8![]() 个,Xn+12
个,Xn+12![]() 个,边长为anm=a
个,边长为anm=a![]() ,体积为
,体积为![]() ,已知该晶体的密度为5.84g·cm-3,5.84g·cm-3=
,已知该晶体的密度为5.84g·cm-3,5.84g·cm-3=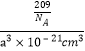 则阿伏加德罗常数NA的计算表示式为
则阿伏加德罗常数NA的计算表示式为![]() 。
。


科目:高中化学 来源: 题型:
【题目】某密闭容器中的反应:3H2(g) + N2(g) ![]() 2NH3(g) △H<0,正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是
2NH3(g) △H<0,正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是

A. 其他条件不变,增大NH3浓度的同时减小N2浓度
B. 其他条件不变,再充入N2和H2
C. 其他条件不变,扩大容器的体积
D. 其他条件不变,降低反应温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水钴矿中除SiO2外,还有9.24%CoO、2.78%Fe2O3、0.96%MgO、0.084%CaO。


(1)在一定浓度的![]() 溶液中,钴的浸出率随时间、温度的变化如图1所示
溶液中,钴的浸出率随时间、温度的变化如图1所示![]() 考虑生产成本和效率,最佳的浸出时间为______小时,最佳的浸出温度为______
考虑生产成本和效率,最佳的浸出时间为______小时,最佳的浸出温度为______![]()
(2)请配平下列除铁的化学方程式:____________
_ _Fe2(SO4)3+ H2O + Na2CO3 == Na2Fe6(SO4)4(OH)12↓+ Na2SO4 + CO2↑
(3) “除钙、镁”的原理反应为:![]() ;
;![]() 已知
已知![]() ,加入过量NaF溶液反应完全后过滤,则滤液中
,加入过量NaF溶液反应完全后过滤,则滤液中![]() ____________________.
____________________.
(4) “沉淀”中含杂质离子主要有![]() 、
、![]() 、_________和__________;“操作X”包括_________和_________。
、_________和__________;“操作X”包括_________和_________。
(5)某锂离子电池正极是![]() ,含
,含![]() 导电固体为电解质
导电固体为电解质![]() 充电时,
充电时,![]() 还原为Li,并以原子形式嵌入电池负极材料碳
还原为Li,并以原子形式嵌入电池负极材料碳![]() 中
中![]() 如图2所示
如图2所示![]() 电池反应为
电池反应为![]()
![]()
![]() ,写出该电池放电时的正极反应式 ________________________________________.
,写出该电池放电时的正极反应式 ________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,往某酸的钠盐Na2A溶液中通入HCl,溶液中![]() 和-lgc(HA-)或
和-lgc(HA-)或![]() 和-1gc(A2-)的关系如图所示。下列说法正确的是
和-1gc(A2-)的关系如图所示。下列说法正确的是

A. 直线L2表示![]() 和-lgc(HA-)的关系
和-lgc(HA-)的关系
B. 通入HCl过程中,水电离的c(OH-)与水电离的c(H+)的乘积不断增大
C. K(H2A)的数量级为10-7
D. 在NaHA溶液中c(Na+)>(HA-)>c(H2A)>c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | 氨水浓度/mol·L-1 | 盐酸浓度/mol·L-1 | 混合溶液pH |
① | 0.1 | 0.1 | pH=5 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH>7 |
请回答下列问题:
(1)①中所得混合溶液c(OH-)=______ mol·L-1。
(2)②中,c______0.2(填“>”“<”或“=”)。
(3)③中所得混合溶液,各离子浓度由大到小的顺序是_______。
(4)①、③所用氨水中的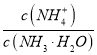 :①_______③(填“>”“<”或“=”)。
:①_______③(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
步骤1:向2 mL 0.005 mol/LAgNO3溶液中加入2 mL 0.005 mol/LKSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/LFe(NO3)3溶液。 | 溶液变为红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3 mol/LAgNO3溶液。 | 现象a,且溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3mol/L KI溶液。 | 出现黄色沉淀。 |
已知:25℃,Ksp(AgI,黄色)= 8.3×1017 ,Ksp (AgSCN,白色 )= 1.0×1012 。
回答下列问题:
(1)步骤3中现象a是________________________________。
(2)用沉淀溶解平衡原理解释步骤4的实验现象________________。
(3)向50 mL 0.005 mol/L的AgNO3溶液中加入150 mL0.005 mol/L的 KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为_____mol/L 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式。
(1)AlCl3水解溶液呈酸性________
(2)将TiCl4加入热水中生成TiO2.xH2O________
(3)向Na2S2O3溶液中加入稀硫酸__________
(4)在Mg(OH)2悬浊液中加入NH4Cl溶液,沉淀溶解___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列性质中,能说明乙醇宜作燃料的是( )
①燃烧时发生氧化还原反应 ②充分燃烧的产物不污染环境
③乙醇是一种再生能源 ④燃烧时放出大量的热
A. ①②③④ B. ①②④ C. ①③④ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属制品进行腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
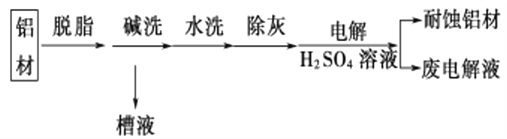
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是__________________(用离子方程式表示)。
为将碱洗后槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的__________。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极的电极反应式为________________________________________________________________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是______________________________________________________________。
(3)利用如图装置,可以模拟铁的电化学防护。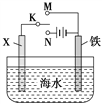
若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。
若X为锌,开关K置于M处,该电化学防护法称为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com