
【题目】常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | 氨水浓度/mol·L-1 | 盐酸浓度/mol·L-1 | 混合溶液pH |
① | 0.1 | 0.1 | pH=5 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH>7 |
请回答下列问题:
(1)①中所得混合溶液c(OH-)=______ mol·L-1。
(2)②中,c______0.2(填“>”“<”或“=”)。
(3)③中所得混合溶液,各离子浓度由大到小的顺序是_______。
(4)①、③所用氨水中的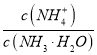 :①_______③(填“>”“<”或“=”)。
:①_______③(填“>”“<”或“=”)。
【答案】 1×10-9 > c(NH4+) > c(Cl-) > c(OH-) > c(H+) >
【解析】⑴.常温下,①中所得混合液的pH=5,c(H+)=10-5mol/L,则c(OH-)= ![]() mol/L=10-9mol/L,故答案为:1×10-9;
mol/L=10-9mol/L,故答案为:1×10-9;
⑵.若c=0.2mol/L,则等体积混合时氨水和盐酸恰好完全反应,得到氯化铵溶液,铵根离子水解使溶液显酸性,现pH=7,溶液呈中性,说明碱要略过量,即c>0.2mol/L,故答案为:>;
⑶.0.2mol/L氨水与0.1mol/L盐酸等体积混合后,得到等浓度的NH3·H2O和NH4Cl的混合溶液,pH>7,说明氨水的电离程度大于铵根离子的水解程度,则各离子浓度由大到小的顺序是c(NH4+) > c(Cl-) > c(OH-) > c(H+),故答案为:c(NH4+) > c(Cl-) > c(OH-) > c(H+);
⑷. NH3·H2O是弱电解质,在溶液中存在电离平衡:NH3·H2O![]() NH4++OH-,电离平衡常数Kb=
NH4++OH-,电离平衡常数Kb=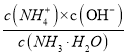 ,则
,则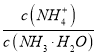 =
=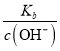 ,增大NH3·H2O的浓度,电离平衡正向移动,OH-浓度增大,①和③相比,③中氨水的浓度大,则③中c(OH-)大于①中c(OH-),c(OH-)越大,
,增大NH3·H2O的浓度,电离平衡正向移动,OH-浓度增大,①和③相比,③中氨水的浓度大,则③中c(OH-)大于①中c(OH-),c(OH-)越大,  =
=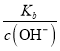 越小,所以①、③所用氨水中的
越小,所以①、③所用氨水中的 :①>③,故答案为:>。
:①>③,故答案为:>。


科目:高中化学 来源: 题型:
【题目】科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料电池用于军事目的。一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:
(1)这种电池放电时发生的化学反应方程式________________。
(2)此电池的正极发生的电极反应式是_______________;负极发生的电极反应式是_________。
(3)电解液中的![]() 离子向__________极移动;向外电路释放电子的电极是__________。
离子向__________极移动;向外电路释放电子的电极是__________。
(4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化效率高,其次是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为前四周期原子序数依次增大的六种元素,A、C、D原子均有两个未成对电子,A、B、C同周期,A与D、B与F分别同主族,E是生活中用量最大的金属。请回答下列问题:
(1)E比较稳定的离子核外电子排布式_____________________________.
(2)A、B、C的第一电离能由小到大的顺序为_________________![]() 用元素符号表示
用元素符号表示![]() 、B、C的简单氢化物中最易汽化的物质的化学式___________.
、B、C的简单氢化物中最易汽化的物质的化学式___________.
(3)C与D形成的物质的晶体类型是____________,IT产业中该晶体用于生产____________.
(4)由A、B、C三种元素中的一种或两种元素形成的分子中,有的互为等电子体,写出其中一组等电子体的化学式:______![]() 并写出对应的结构式_______________.
并写出对应的结构式_______________.
(5)B的单质晶胞与![]() 的相似,则一个晶胞中含B的原子个数为____
的相似,则一个晶胞中含B的原子个数为____![]() 与氢形成的分子空间构型是_______.
与氢形成的分子空间构型是_______.
(6)“砒霜”是一种含C,F的化合物,其分子结构如图1所示,该化合物的分子式为F4C6,F原子采取______杂化;C,D,E组成的化合物的晶胞如图2,其晶胞参数为a pm,则其密度为___________________g/cm3(列出式子即可,阿伏伽德罗常数为NAmol-1)。

查看答案和解析>>
科目:高中化学 来源: 题型:
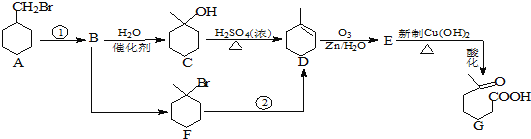
【题目】![]() 羰基庚酸是一种重要的化工中间体,下面合成它的流程图:
羰基庚酸是一种重要的化工中间体,下面合成它的流程图:
已知:![]()
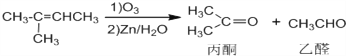
![]()
回答下列问题:
(1)反应![]() 的条件是 _______________ ;1mol化合物C完全燃烧需要消耗O2 ___________ mol
的条件是 _______________ ;1mol化合物C完全燃烧需要消耗O2 ___________ mol
(2)G所含的官能团的名称是 _____________________ ;
(3)下列说法中正确的是 ______________ :
![]() 与足量的Na反应生成
与足量的Na反应生成![]()
![]() 能被催化氧化成酮
能被催化氧化成酮
![]() 在Ni催化下1molG最多只能与
在Ni催化下1molG最多只能与![]() 加成
加成 ![]() 能发生消去反应生成两种不同烯烃
能发生消去反应生成两种不同烯烃
(4)E与新制![]() 的化学方程式为 _________________。
的化学方程式为 _________________。
(5)G的同分异构体有多种,请写出符合下列要求的同分异构体:___________________________________________________
①结构中含有 ②属于酯类 ③能发生银镜反应
②属于酯类 ③能发生银镜反应
(6)写出以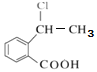 为原料制备
为原料制备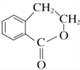 的合成路线流程图
的合成路线流程图![]() 无机试剂任用
无机试剂任用![]() ,并注明反应条件。_________________
,并注明反应条件。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三种等体积等物质的量浓度的NaOH溶液。若将甲蒸发一半水,在乙中通入少量CO2,丙不变,然后用等浓度的H2SO4溶液滴定,用甲基橙作指示剂。完全反应后,所需溶液体积是( )
A.甲=丙>乙 B.丙>乙>甲 C.乙>丙>甲 D.甲=乙=丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)福州大学王新晨教授以氨基氰(CH2N2)为原料制得类石墨相氮化碳(g-C3N4),其单层结构如图1。

①氨基氰CH2N2)分子中C、N原子均满足8电子稳定结构,则该分子的结构式为______;该分子为______(填“极性”或“非极性”)分子。
②氨基氰易溶于水或乙醇,其主要原因是_____________。
③关于g- C3N4的叙述正确的是_________。
A.电负性:C>N B.该物质的熔点比石墨更高
C.该物质属于原子晶体 D.该物质中C和N原子均采取SP2杂化
(2)NH3与Zn2+可形成[Zn(NH3)6]2+离子,部分结构如图2。

①NH3的空间构型为_________。
②[Zn(NH3)6]2+离子中存在的化学键类型有______;NH3分子中H-N-H键角为107.3°,判断[Zn(NH3)6]2+离子中H-N-H键角______107.3°(填">”、"<”或“=”)。
③肼(N2H4)可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。与N2H4互为等电子体的分子有_______。(写一种)
(3)N元素形成的简单离子N3-与Xn+形成的晶体的是立方体结构,边长为anm,如图3所示。

①Xn+中所有的电子恰好充满K、L、M三个电子层,则基态X原子的价电子的轨道表示式为________。
②已知该晶体的密度为5.84g·cm-3,则阿伏加德罗常数NA的计算表示式为_____(含a)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究氨气及氨水的还原性,某兴趣小组同学设计了以下探究活动。
I.探究氨气的还原性
该兴趣小组同学利用以下装置(夹持,加热仪器略)探究氯气与氨气的反应,其中A、F分别为氯气和氨气的发生装置,B为纯净干燥的氯气与氨气反应的装置。
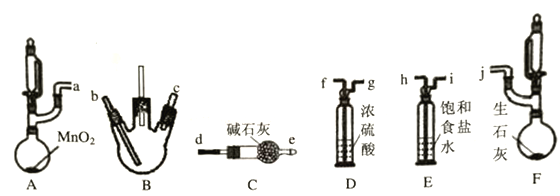
请回答下列问题:
(1)上述装置接口的连接顺序为a接h、i接f、g接___、____接___、____接j,其中装置D的作用是____________。
(2)若氨气足量,装置B中出现的现象为____________。
II.探究氨水的还原性
该兴趣小组同学探究不同条件下高锰酸钾溶液与氨水的反应,实验如下:
实验 | 操作 | 现象 |
① | 取2mL.0.01mol/LKMnO4溶液于试管中,加入新开封1mL浓氨水,加入半滴管蒸馏水,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),约10min后溶液紫红色变浅 |
② | 取2mL0.01mol/LKMnO4溶液于试管中,加入新开封1mL浓氨水,加入半滴管1:5的硫酸,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),溶液紫红色立刻变浅,约2min后溶液紫红色完全退去 |
③ | 取2mL0.1mol/LKMnO4溶液于试管中,加入新开封ImL浓氨水,加入半滴管蒸馏水,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),约10min后溶液紫红色变浅 |
④ | 取2mL0.1mol/LKMnO4溶液于试管中,加入新开封1mL浓氨水,加人半滴管1:5的硫酸,振荡,用橡皮塞塞住。 | 产生棕褐色物质(MnO2),溶液紫红色立刻变浅,约5min后溶液紫红色完全退去 |
(3)实验①中氧化产物为N2,写出该反应的离子方程式:_________。
(4)实验①②说明________________。
(5)实验②比实验④反应速率_____(填“快“或“慢”),原因是_________。
(6)1:5的硫酸溶液(密度为ρ2g·cm-3),可用质量分数为98%的浓硫酸(密度为ρ1g·cm-3)和
蒸馏水按体积比1:5配成,则该1:5的硫酸溶液的物质的量浓度为_____mol/L。(用含ρ1、ρ2的式子表示)
(7)由实验I、II可得出的结论是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) ( )
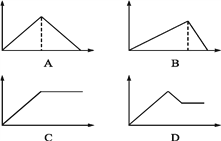
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Fe、FeO、Fe2O3和Fe3O4组成的混合物,取一定质量,加入100 mL 4 mol/L的盐酸,混合物恰好完全溶解,放出a mL(标准状况下)的气体,所得溶液中加入KSCN溶液无血红色出现。若取等质量的该混合物,用足量的CO还原可得铁单质的质量为
A.2.8g B.5.6g C. 8.4g D.11.2 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com