
【题目】磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。磷的化合物在药物生产和农药制造等方面用途非常广泛。请回答下列有关问题:
(1)画出基态P原子的核外电子排布图__________。
(2)NH3比PH3易液化的原因是_________。
(3)P4S3可用于制造火柴,其结构如图1所示。
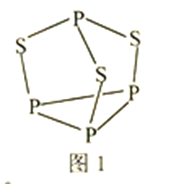
①P4S3中硫原子的杂化轨道类型为________。
②电负性:磷_____硫(填“>”或“<”);第一电离能磷大于硫的原因是________。
(4)NH4BF4是合成氮化硼纳米管的原料之一,1molNH4BF4中含有____mol配位键。
(5)NF3的键角小于NH3的键角,其原因是____________。
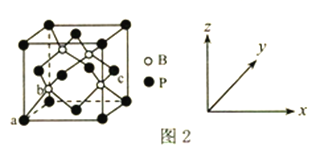
(6)磷化硼是一种超硬耐磨涂层材料,其晶胞结构如图2所示。原子坐标参数表示晶胞内部各原子的相对位置,图中a点和c点的原子坐标参数依次为(0,0,0)、(1,![]() ,
,![]() ),则b点的原子坐标参数为________;已知该晶胞中距离最近的两个磷原子的核间距离为Lpm,则该晶体密度为_____g.cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
),则b点的原子坐标参数为________;已知该晶胞中距离最近的两个磷原子的核间距离为Lpm,则该晶体密度为_____g.cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
【答案】 ![]() NH3分子间存在氢鍵 sp3 < 磷原子3p轨道处于半满状态,不容易失去电子 2 F的电负性大于H,故NF3中N的周围的电子密度小于NH3中N周围电子密度
NH3分子间存在氢鍵 sp3 < 磷原子3p轨道处于半满状态,不容易失去电子 2 F的电负性大于H,故NF3中N的周围的电子密度小于NH3中N周围电子密度 ![]()
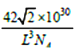
【解析】(1)P原子核电荷数为15,电子排布为1s22s22p63s23p3,核外电子排布图![]() ;正确答案:
;正确答案: ![]() 。
。
(2)NH3分子间存在氢鍵,PH3分子间无氢键,因此NH3比PH3易液化;正确答案:NH3分子间存在氢鍵。
(3)①P4S3中硫原子形成2个共价键,孤电子对数为1/2×(6-2×1)=2,则有4个价层电子对,其杂化的轨道类型为sp3;正确答案:sp3。
②同一周期,从左到右,电负性增大,因此电负性:磷<硫;同一周期,第一电离能呈现增大的趋势,由于磷原子3p轨道处于半满状态,不容易失去电子,第一电离能磷大于硫;正确答案: <;磷原子3p轨道处于半满状态,不容易失去电子。
(4)一个NH4BF4中N原子和其中一个H原子之间存在配位键、B原子和其中一个F原子之间存在一个配位键,所以含有2个配位键,则1mol NH4BF4含有2mol配位键;正确答案:2。
(5)F的电负性大于H,故NF3中N的周围的电子密度小于NH3中N周围电子密度,因此NF3的键角小于NH3的键角;正确答案:F的电负性大于H,故NF3中N的周围的电子密度小于NH3中N周围电子密度。
(6)图中a点坐标参数为(0、0、0)、c点坐标参数为(1、![]() 、
、![]() ),说明晶胞边长为1,a、c点距离为晶胞对角线的
),说明晶胞边长为1,a、c点距离为晶胞对角线的![]() ,则c点的原子坐标参数为(
,则c点的原子坐标参数为(![]() 、
、![]() 、
、![]() );根据晶胞结构可知:硼原子个数为4,磷原子个数为8×1/8+6×1/2=4,即该晶胞中含有4个磷化硼,质量为4×42/NAg, 设该晶胞的棱长为xcm,该晶胞中距离最近的两个磷原子的核间距离为面对角线上的一半,所以x=
);根据晶胞结构可知:硼原子个数为4,磷原子个数为8×1/8+6×1/2=4,即该晶胞中含有4个磷化硼,质量为4×42/NAg, 设该晶胞的棱长为xcm,该晶胞中距离最近的两个磷原子的核间距离为面对角线上的一半,所以x=![]() L×10-10cm,晶胞的体积为x3=(
L×10-10cm,晶胞的体积为x3=(![]() L)3×10-30 cm3;设晶胞的密度为ρg.cm-3,则ρ=[4×42/NA]÷[(
L)3×10-30 cm3;设晶胞的密度为ρg.cm-3,则ρ=[4×42/NA]÷[(![]() L)3×10-30] =
L)3×10-30] =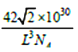 g.cm-3;正确答案:
g.cm-3;正确答案:![]() ;
;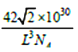 。
。


科目:高中化学 来源: 题型:
【题目】水钴矿中除SiO2外,还有9.24%CoO、2.78%Fe2O3、0.96%MgO、0.084%CaO。


(1)在一定浓度的![]() 溶液中,钴的浸出率随时间、温度的变化如图1所示
溶液中,钴的浸出率随时间、温度的变化如图1所示![]() 考虑生产成本和效率,最佳的浸出时间为______小时,最佳的浸出温度为______
考虑生产成本和效率,最佳的浸出时间为______小时,最佳的浸出温度为______![]()
(2)请配平下列除铁的化学方程式:____________
_ _Fe2(SO4)3+ H2O + Na2CO3 == Na2Fe6(SO4)4(OH)12↓+ Na2SO4 + CO2↑
(3) “除钙、镁”的原理反应为:![]() ;
;![]() 已知
已知![]() ,加入过量NaF溶液反应完全后过滤,则滤液中
,加入过量NaF溶液反应完全后过滤,则滤液中![]() ____________________.
____________________.
(4) “沉淀”中含杂质离子主要有![]() 、
、![]() 、_________和__________;“操作X”包括_________和_________。
、_________和__________;“操作X”包括_________和_________。
(5)某锂离子电池正极是![]() ,含
,含![]() 导电固体为电解质
导电固体为电解质![]() 充电时,
充电时,![]() 还原为Li,并以原子形式嵌入电池负极材料碳
还原为Li,并以原子形式嵌入电池负极材料碳![]() 中
中![]() 如图2所示
如图2所示![]() 电池反应为
电池反应为![]()
![]()
![]() ,写出该电池放电时的正极反应式 ________________________________________.
,写出该电池放电时的正极反应式 ________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式。
(1)AlCl3水解溶液呈酸性________
(2)将TiCl4加入热水中生成TiO2.xH2O________
(3)向Na2S2O3溶液中加入稀硫酸__________
(4)在Mg(OH)2悬浊液中加入NH4Cl溶液,沉淀溶解___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列性质中,能说明乙醇宜作燃料的是( )
①燃烧时发生氧化还原反应 ②充分燃烧的产物不污染环境
③乙醇是一种再生能源 ④燃烧时放出大量的热
A. ①②③④ B. ①②④ C. ①③④ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施是为了降低化学反应速率的是( )
A.合成氨的反应中,选择“触媒”作催化剂
B.保存浓硝酸时,通常用棕色瓶并放在阴凉处
C.在试管中进行铝和氢氧化钠溶液反应时,稍微加热
D.用纯锌与稀硫酸反应制取氢气时,在溶液中加入少量硫酸铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】塑料废弃物又称“白色污染”,它的危害有
①难以分解,破坏土壤结构,影响植物生长②污染海洋③危及海洋生物的生存 ④破坏环境卫生,污染地下水
A. ①②③④ B. ①③④ C. ②③④ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的( )
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的( )
A. 1 molKClO3参加反应有1mole- 转移 B. ClO2是氧化产物
C. H2C2O4在反应中被还原 D. KClO3在反应中得到电子,作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属制品进行腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
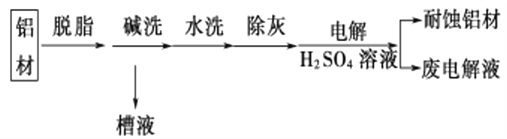
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是__________________(用离子方程式表示)。
为将碱洗后槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的__________。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极的电极反应式为________________________________________________________________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是______________________________________________________________。
(3)利用如图装置,可以模拟铁的电化学防护。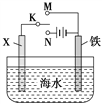
若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。
若X为锌,开关K置于M处,该电化学防护法称为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3,试管中各有10mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是
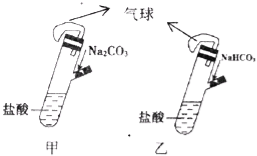
A. 甲装置的气球膨胀速率大
B. 若最终两气球体积相同,则一定有c(HCl)≥2 mol/L
C. 若最终两气球体积不同,则一定有c(HCl)≤1 mol/L
D. 最终两溶液中Na+、Cl﹣的物质的量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com