
【题目】下列实验方法能达到目的是
A. 用焰色反应鉴別Na2CO3溶液和NaCl溶液
B. 用分液漏斗分离食醋中的乙酸与水
C. 用结晶的方法分离氯化钠和硝酸钾的混合物
D. 用NaOH溶液除去Cl2中混有的少量HCl
科目:高中化学 来源: 题型:
【题目】球墨铸铁中含有一种铁碳化合物X。实验小组为测定化合物X的组成设计实验如下:

下列说法不正确的是
A. 固体2是氧化铁
B. X的化学式可以表示为Fe3C2
C. 溶液甲加热、蒸发、灼烧也可得到24.0g固体
D. X与足量的热浓硝酸反应有NO2和CO2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
(1)已知:①2CO(g)+O2(g)=2CO2(g) H1=a kJmol-1
②2NO(g)+2CO(g) N2(g)+ 2CO2(g) H2=b kJmol-1
则反应N2(g)+ O2(g)= 2NO(g)的H=____________kJmol-1(用a、b表示)。
(2)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,20S反应达平衡,此时CO的物质的量为1.6 mol。请回答下列问题:
①前20S内平均反应速率v(NO)为 ____________。
②在该温度下反应的平衡常数K=________。
③关于上述反应,下列叙述不正确的是_______(填编号)。
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和压强不变,再向容器中充入0.4molCO和0.8mol N2,则此时v正>v逆
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ。若其它条件不变,将0.5 mol NO、2 mol CO投入2 L容器进行反应,请在答题卡图中绘出c(CO)与反应时间t1变化曲线Ⅱ。______________
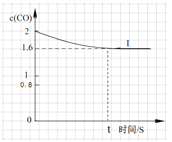
(3)测试某汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线如下图
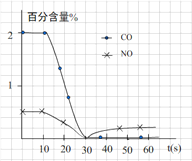
请回答:前0—10 s 阶段,CO、NO百分含量没明显变化的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得某溶液中仅含有K+、Cu2+、SO42-、Cl-四种离子,其中K+、Cu2+、Cl - 三种离子的个数比为4 : 5 : 8,则K+与SO42-的物质的量比为 ( )
A.4:3
B.4:1
C.2:3
D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10.0mL 0.10 mol·L-1某二元酸H2R溶液中滴加入同物质的量浓度的NaOH溶液,测得溶液的pH随NaOH溶液体积的变化如右图所示。下列说法中正确的是
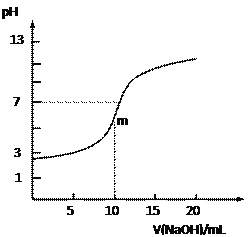
A. 无法判断H2R是强酸还是弱酸
B. 曲线上m点时溶液中c(Na+)>c(HR-) >c(R2-)>c(H+)
C. HR-的电离能力大于水解能力
D. 溶液中c(Na+)+c(H+)=c(HR-)+c(R2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿石的主要成分为FeS2和少量FeS(假设其它杂质中不含铁、硫元素,且高温下不发生化学变化),它是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为4FeS2+11O2=2Fe2O3+8SO2,4FeS+7O2=2Fe2O3+4SO2
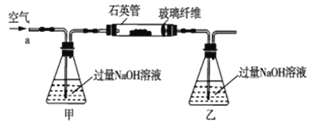
(实验一)测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:
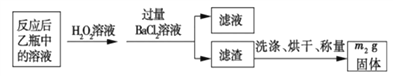
(1)鼓入空气的作用是_____________________。
(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是___________(用化学方程式表示)。H2O2可以看成是一种很弱的酸,写出其主要的电离方程式为____________________。
(3)该黄铁砂石中硫元素的质量分数为____________________(列出表达式即可)。
(实验二)测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤 ③将过滤液稀释至250mL
④取25.00mL稀释液,用0.100mol·L-1的酸性KMnO4溶液滴定
(4)步骤②中,若用铁粉作还原剂,则所测得的铁元素的含量__________(填“偏大”“ 偏小” 或“无影响”)。
(5)请写出步骤②中洗涤的方法____________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
第一次 | 第二次 | 第三次 | 第四次 | |
消耗KMnO4溶液体积/ml | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度c(Fe2+)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图。
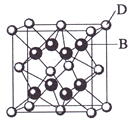
请回答:
(1)A元素的名称是 ;
(2)B的元素符号是 ,C的元素符号是 ,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
(3)E属元素周期表中第 周期,第 族的元素,其元素名称是 , 它的+2价离子的电子排布式为 :
(4)从图中可以看出,D跟B形成的离子化合物的化学式为 ;该离子化合 物晶体的密度为ag·cm-3,则晶胞的体积是 (只要求列出算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A原子中只含1个电子;B原子的3p轨道上得到1个电子后不容纳外来电子;C原子的2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D原子的第三电子层上有8个电子,第四电子层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)按要求书写下列图式。
①B原子的结构示意图:________;
②C原子的电子排布图:________;
③D原子的核外电子排布式:________;
④B离子的电子式:________。
(2)写出由A、B、C、D中的三种元素组成的化合物的化学式:___________(至少写出5种)。
(3)写出由上述元素组成的物质制得A的单质的化学方程式:___________(至少写出2个)。
(4)写出E的元素符号:________,要证明太阳光中含有E元素,可采用的方法是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com