
【题目】常温下,向10.0mL 0.10 mol·L-1某二元酸H2R溶液中滴加入同物质的量浓度的NaOH溶液,测得溶液的pH随NaOH溶液体积的变化如右图所示。下列说法中正确的是
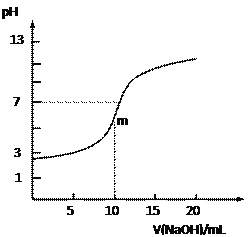
A. 无法判断H2R是强酸还是弱酸
B. 曲线上m点时溶液中c(Na+)>c(HR-) >c(R2-)>c(H+)
C. HR-的电离能力大于水解能力
D. 溶液中c(Na+)+c(H+)=c(HR-)+c(R2-)+c(OH-)
科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都正确的是
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 |
B | 淀粉水解后的溶液加入新制Cu(OH)2浊液,再加热 | 无砖红色沉淀 | 淀粉水解产物不含醛基 |
C | 用铂丝蘸取少量溶液进行焰色反应 | 火焰呈黄色 | 该溶液是钠盐溶液 |
D | 向盛有1mL0.l mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1 nol/L的NaI溶液,再振荡, | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A. 乙醇和乙酸均可与NaOH溶液发生酸碱中和反应
B. 苯分子中存在典型的碳碳双键,可发生加成反应
C. 苯分子能发生取代反应
D. 加热银氨溶液与淀粉溶液的混合液可用于检验淀粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学兴趣小组为了调查当地某一湖泊的水质污染情况,在注入湖泊的3个主要水源的入口处采集水样,并进行了分析,给出了如下实验信息:其中一处水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E为五种常见化合物,均由下表中的离子形成,其中C中有两种阳离子:

为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出C、D的化学式:C________,D________。
(2)将含1 mol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为___________。
(3)在A溶液中加入少量澄清石灰水,其离子方程式为_____________________________。
(4)若向含溶质l mol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED铝片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主。已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如图。试回答:

(1)镓的基态原子的电子排布式是_____________________________________。
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为________,与同一个镓原子相连的砷原子构成的立体构型为________。
(3)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是________。(用氢化物分子式表示)
(4)砷化镓可由(CH3)3Ga和AsH3在700 ℃时制得。(CH3)3Ga中镓原子的杂化方式为________。
(5)比较二者的第一电离能:As________Ga(填“<”“>”或“=”)。
(6)下列说法正确的是________。
A.砷化镓晶胞结构与NaCl相同
B.GaP与GaAs互为等电子体
C.电负性:As>Ga
D.砷化镓晶体中含有配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法能达到目的是
A. 用焰色反应鉴別Na2CO3溶液和NaCl溶液
B. 用分液漏斗分离食醋中的乙酸与水
C. 用结晶的方法分离氯化钠和硝酸钾的混合物
D. 用NaOH溶液除去Cl2中混有的少量HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为________________________________________________________________________。
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是________________________________________________________________________。
(3)SO![]() 中S以sp3杂化,SO
中S以sp3杂化,SO![]() 的立体构型是________。
的立体构型是________。
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,金原子最外层电子排布式为____________。一种铜合金晶体具有立方最密堆积的结构,在晶胞中铜原子处于面心,金原子处于顶点位置,则该合金中铜原子与金原子数量之比为________;该晶体中,原子之间的作用力是________________________________________________________________________。
(5)CuSO4晶体的构成微粒是________和________,微粒间的作用力是________,该晶体属于________晶体。
(6)上述晶体具有储氢功能,氢原子可进入到由铜原子与金原子构成的四面体空隙中。若将铜原子与金原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式应为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1949年度诺贝尔化学奖授予为研究臭氧做出贡献的化学家。臭氧能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图:呈V形,键角116.5°。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子提供1个电子,构成一个特殊的化学键(虚线内部分)——三个O原子均等的享有着4个电子。请回答:
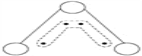
(1)题中非极性共价键是__键,特殊的化学键是 键。
(2)臭氧与氧气是_____。
(3)下列物质的分子与O3分子的结构最相似的是_______。
A.H2O B.CO2 C.SO2 D.BeCl2
(4)子中某一原子有1对没有跟其他原子共用的电子叫孤电子对,那么 O3分子有___对孤电子对。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸钴[Cox(OH)y(CO3)z]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示装置进行实验。
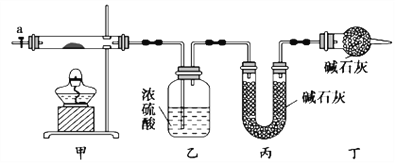
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中____________(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是_______________。
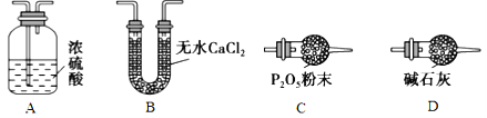
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的_______(填字母)连接在__________(填装置连接位置)。
(4)若按正确装置进行实验,测得如下数据:则该碱式碳酸钴的化学式为______________。
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
(5)CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:
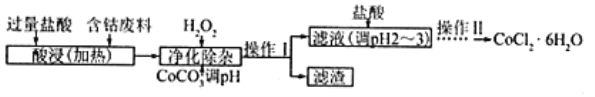
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净除杂质时,加入H2O2发生反应的离子方程式为_____________。
②加入CoCO3调pH为5.2~7.6,则操作Ⅰ获得的滤渣成分为_____________________。
③加盐酸调整pH为2~3的目的为_________________。
④操作Ⅱ过程为_______________(填操作名称)、过滤。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com